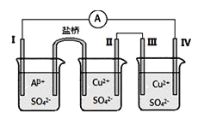
题目内容
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车电池反应为FePO4+Li![]() LiFePO4。下列有关LiFePO4电池的说法不正确的是( )
LiFePO4。下列有关LiFePO4电池的说法不正确的是( )
A.该电池充电时,阳极的电极反应式为:LiFePO4-e-=FePO4+Li+
B.该电池可用H2SO4溶液作电解质溶液
C.该电池放电时,电池内部的Li+向正极移动
D.在该电池的放电过程中,电池正极的质量逐渐增加
【答案】B
【解析】
A.放电时电池正极反应为:FePO4+Li++e-═LiFePO4,所以该电池充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+,故A正确;
B.锂与H2SO4溶液电离产生氢离子发生氧化还原反应,所以正极是氢离子得电子,生成氢气,故B错误;
C.原电池中阳离子向正极移动,则该电池放电时,电池内部的Li+向正极移动,故C正确;
D.正极反应式为FePO4+Li++e-═LiFePO4,所以电池正极的质量逐渐增加,故D正确;
故答案为B。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
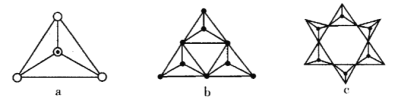
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。