题目内容
6.实验室里可用如图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质.
如图中①为氯气发生装置;②的试管中盛有15mL 30%的KOH溶液,并置于水浴中;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管中加有紫色石蕊试液;⑤为尾气吸收装置.
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过分液漏斗.
(填写仪器名称)向烧瓶中加入适量的浓盐酸.(填写试剂名称)
(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有b.(选填字母编号)的净化装置.
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)本实验制取次氯酸钠的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(4)比较制取氯酸钾和次氯酸钠的条件,两者的差异是反应的温度不同、反应物浓度不同.
(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为红色,原因是氯气与水反应生成酸使石蕊显红色;
接着溶液逐渐变为无色,是因为氯气与水反应生成次氯酸将石蕊氧化为无色.
分析 (1)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用分液漏斗加入浓盐酸;
(2)除去氯气中混有的氯化氢气体,可将混合气体通过饱和食盐水;
(3)氯气和碱在常温下反应生成NaClO和NaCl,以此书写反应的离子方程式;
(4)制取氯酸钾和次氯酸钠的浓度和温度不同;
(5)根据氯气与水反应生成HCl和HClO判断.
解答 解:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,
故答案为:分液漏斗;浓盐酸;
(2)生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:b;
(3)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,二者在水中溶解且电离,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,
故答案为:反应的温度不同、反应物浓度不同;
(5)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,
故答案为:氯气与水反应生成酸使石蕊显红色;氯气与水反应生成次氯酸将石蕊氧化为无色.
点评 本题考查氯气的制备、性质,主要是实验过程分析应用,注意物质性质的理解分析,题目难度中等,做题时注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在氢气还原氧化铜的实验中( )
| A. | 氧化铜发生还原反应 | B. | 氢气发生还原反应 | ||
| C. | 铜发生还原反应 | D. | 水发生还原反应 |
2.化学与生产、生活联系密切,下列说法正确的是( )
| A. | 常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 | |
| B. | 氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| C. | 氮氧化物可以破坏臭氧层,也能形成酸雨 | |
| D. | “玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 |
1.(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体.
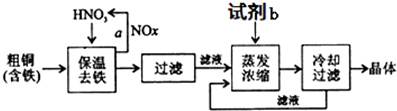
①在步骤a中,还需要通入氧气和水,其目的是将NOx氧化成HNO3;写出化学方程式4NOx+(5-2x)O2+2H2O=4HNO3;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加人CuO调节溶液的pH.根据下表数据,溶液的pH应保持在3.2≤pH<4.7的范围内;
③进行蒸发浓缩时,加入的试剂b为硝酸溶液,其目的是(结合离子方程式说明)由于Cu2+发生水解Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可抑制Cu2+的水解防止Cu(OH)2的生成.
(2)①某人设想以下图所示装置将NOx转化为硝酸,装置一可用于由N2O4制备N2O5(硝酸的酸酐),装置二用于将NO2转化为硝酸,写出通入NO2的电极的电极反应式:NO2-e-+H2O=NO3-+2H+;电解池阳极反应:N2O4+2HNO3-2e-=2N2O5+2H+.
②若通入NO2的速率为2.24L/min(标准状况),为稳定持续生产,硝酸溶液的浓度应维持质量分数50%不变,则左侧水的流入速率应为7.2mL/min.


①在步骤a中,还需要通入氧气和水,其目的是将NOx氧化成HNO3;写出化学方程式4NOx+(5-2x)O2+2H2O=4HNO3;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加人CuO调节溶液的pH.根据下表数据,溶液的pH应保持在3.2≤pH<4.7的范围内;
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)①某人设想以下图所示装置将NOx转化为硝酸,装置一可用于由N2O4制备N2O5(硝酸的酸酐),装置二用于将NO2转化为硝酸,写出通入NO2的电极的电极反应式:NO2-e-+H2O=NO3-+2H+;电解池阳极反应:N2O4+2HNO3-2e-=2N2O5+2H+.
②若通入NO2的速率为2.24L/min(标准状况),为稳定持续生产,硝酸溶液的浓度应维持质量分数50%不变,则左侧水的流入速率应为7.2mL/min.

18.按照物质的树状分类和交叉分类,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物.
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑥⑦⑧ | C. | ①⑧ | D. | ①④⑤⑥⑦ |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使紫色石蕊变红色的溶液:Mg2+、K+、CO32-、NO3-、H+ | |
| B. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-、OH- | |
| C. | 常温下能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ | |
| D. | 含有0.1 mol•L-1 Ca2+的溶液中:Na+、K+、CO32-、Cl- |
16.利用海洋资源获得的部分物质如图所示,有关说法正确的是( )

| A. | 在化学反应中,${\;}_{1}^{1}$H2O可转变为D2O | |
| B. | “加碘食盐”生产中碘添加剂为单质I2 | |
| C. | 实验室用带玻璃塞的棕色瓶贮存液Br2 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
 HCN+OH-
HCN+OH-