题目内容
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
【答案】 ![]() 或
或![]() 2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=
2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=![]() >Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
>Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
【解析】试题分析:(1)根据盖斯定律书写用CO还原NO2至N2的热化学方程式,再根据热化学方程式计算消耗标准状况下3.36L CO时放出的热量;(2) ①根据![]() 计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
解析:(1) ①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0);②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0);根据盖斯定律①![]() ②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量
②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量![]() kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
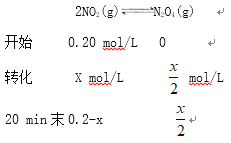
![]()
X=0.08mol,v(N2O4)= ![]() mol/L
mol/L ![]() = 2.0×10-3。
= 2.0×10-3。
②设平衡时N2O4的浓度x mol/L,
![]()
![]()
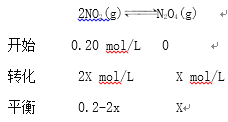
![]()
X=0.075 mol/L,v(NO2):v(N2O4)=2:1即k1·c2(NO2):k2·c(N2O4)=2:1,k1![]() 0.0025:k2
0.0025:k2![]() 0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是
0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是![]() ,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。
,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。