题目内容
【题目】298K时,在20.00 mL 0.1 mol·L-1 C6H5COOH(苯甲酸)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液中离子浓度与pH关系如图所示。下列说法正确的是
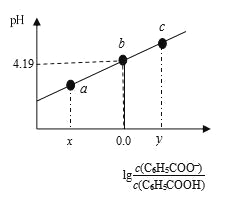
A. a点:溶液中c(Na+)>c(C6H5COO-)>c(H+)>c(OH-)
B. b点:对应的NaOH溶液体积为10 mL
C. 对b点溶液加热(不考虑挥发),实现曲线由b点向c点的变化
D. 298K时,C6H5COOH的电离常数为1×10-4.19
【答案】D
【解析】
A.由题图知,a点溶液呈酸性,根据电荷守恒c(H+)+c(Na+)=c(C6H5COO-)+c(OH-)可知离子浓度大小排序为c(C6H5COO-)>c(Na+)>c(H+)>c(OH-),A错误;
B.加入氢氧化钠溶液的体积为10.00mL时,溶液中的溶质为C6H5COONa、C6H5COOH且二者浓度相等,C6H5COOH的电离方程式为C6H5COOH![]() H++C6H5COO-,由于电离常数与浓度无关,选择b点计算Ka,Ka=c(H+)·c(C6H5COO-)/c(C6H5COOH)≈c(H+)=1×10-4.19,C6H5COOH的电离程度大于C6H5COO-的水解程度,则溶液中c(C6H5COO-)>c(C6H5COOH),而b点溶液中c(C6H5COO-)=c(C6H5COOH),故加入的氢氧化钠溶液体积小于10.00mL,B错误;
H++C6H5COO-,由于电离常数与浓度无关,选择b点计算Ka,Ka=c(H+)·c(C6H5COO-)/c(C6H5COOH)≈c(H+)=1×10-4.19,C6H5COOH的电离程度大于C6H5COO-的水解程度,则溶液中c(C6H5COO-)>c(C6H5COOH),而b点溶液中c(C6H5COO-)=c(C6H5COOH),故加入的氢氧化钠溶液体积小于10.00mL,B错误;
C.b点溶液中存在C6H5COOH、C6H5COONa,对b点溶液加热,,C6H5COOH的电离程度增大,溶液的pH降低,可实现曲线由b点向a点的变化,C错误;
D.根据以上分析可知D项正确;
答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目