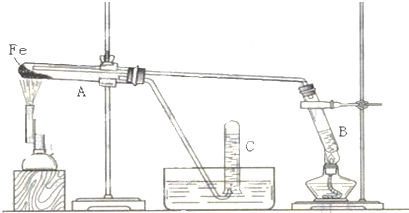
题目内容
9.向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论正确的是( )
| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | p点横坐标为120 | |
| C. | p点中溶质为Ba(HCO3)2 | |
| D. | ab段反应可分两段,离子方程式依次为:CO2+2OH-=H2O+CO32- CO2+H2O+CO32-=2HCO3- |
分析 向KOH和Ba(OH)2的混合稀溶液中通入CO2,首先二氧化碳和氢氧化钡反应生成碳酸钡沉淀;当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾;当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡,
A.根据OA段负:Ba2++2OH-+CO2═BaCO3↓+H2O,ab段反应:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-分析解答;
B.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-分析解答;
C.p点溶液中溶质为Ba(HCO3)2、KHCO3;
D.a,b段反应分二阶段,先是二氧化碳和氢氧化钾反应生成碳酸钾,后是二氧化碳和碳酸钾、水反应生成碳酸氢钾.
解答 解:向KOH和Ba(OH)2的混合稀溶液中通入CO2,首先二氧化碳和氢氧化钡反应生成碳酸钡沉淀;当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾;当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡,
A.OA段发生反应:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳,ab段反应为:2OH-+CO2═CO32-+H2O、ab段消耗(60-30)mL的二氧化碳;bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,由Oa段和ac段的反应原理可知,消耗二氧化碳的量Ba(OH)2和KOH的物质的量相等,所以原混合溶液中Ba(OH)2和KOH的物质的量之比为30:(60-30)=1:1,故A错误;
B.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,需消耗30mL的二氧化碳,所以p点为90mL,故B错误;
C.ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,最后是BaCO3+CO2+H2O═Ba2++2HCO3-,所以p点溶液中溶质为Ba(HCO3)2、KHCO3,故C错误;
D.a,b段,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,CO2+2OH-=CO32-+H2O,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,CO32-+H2O+CO2=2HCO3-,故D正确;
故选D.
点评 本题考查了混合物反应的反应,题目难度中等,明确物质的性质及反应先后顺序为解答本题的关键,试题侧重考查了学生的分析、理解能力化学计算能力.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案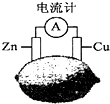
| A. | 将电能转换为化学能 | B. | 电子由铜片流出经导线到锌 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧柠檬变蓝色,产生Cu2+ |
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | 高铁酸钾(K2FeO4)是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| D. | 测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等 |
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
| A. | 中性溶液中:Fe3+、K+、Cl-、SO42- | |
| B. | 在澄清透明溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 酸性溶液中:Na+、K+、ClO-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、K+、Cl-、SO32- |
 ,其NMR谱中有两个信号峰,强度之比为3:1.
,其NMR谱中有两个信号峰,强度之比为3:1.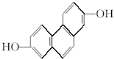 的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;
的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;