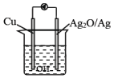
题目内容
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
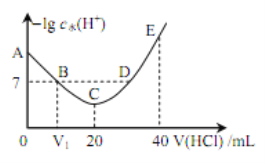
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
【答案】B
【解析】A、B点的溶液为NH3OHCl、NH2OH,B点此时应为中性,故V1=10,故A错误;B、A点时,NH2OH+H2O ![]() NH3OH++OH-,c(OH-)=c(NH3OH+),c(NH2OH)
NH3OH++OH-,c(OH-)=c(NH3OH+),c(NH2OH)![]() 0.l mol·L-1,c(OH-)2=
0.l mol·L-1,c(OH-)2=![]() =9.0×l0-10,c(OH-)=3.0×l0-5,c(H+)=
=9.0×l0-10,c(OH-)=3.0×l0-5,c(H+)=![]() 10-9,pH=-lg c(H+)=9.5,故B正确;C、C点时,溶液为NH3OHCl溶液,此时溶液呈酸性,再加入盐酸,酸性更强,故D点不是中性,故C错误;D、E点为等浓度的NH3OHCl和HCl溶液,质子守恒为:c(H+)=c (OH-)+c (NH3OH+)+2c (NH2OH),故D错误;故选B。
10-9,pH=-lg c(H+)=9.5,故B正确;C、C点时,溶液为NH3OHCl溶液,此时溶液呈酸性,再加入盐酸,酸性更强,故D点不是中性,故C错误;D、E点为等浓度的NH3OHCl和HCl溶液,质子守恒为:c(H+)=c (OH-)+c (NH3OH+)+2c (NH2OH),故D错误;故选B。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目