题目内容
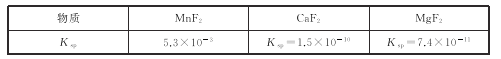
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
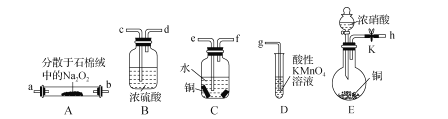
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
【答案】圆底烧瓶 先关闭弹簧夹 ,从滴液漏斗处倒水,若形成一段稳定的水柱,则证明装置气密性好 e-f-c-d-a-b-g 5NO+3MnO4-+4H+=3Mn2++ 5NO3-+2H2O 有气泡产生,液面上方变红 0.69mg/L 偏低
【解析】
(1) (2)根据实验安全与操作,进行分析;
(3)根据信息可知,酸性高锰酸钾溶液能够把剩余的氮的氧化物吸收处理;
(4)弱酸盐与强酸反应,生成弱酸,再根据HNO2的性质作答;
(5) NO2-可将MnO4-还原为Mn2+,根据化合价变化可得反应的关系式:2MnO4-~5NO2-,多余的高锰酸钾,可将草酸根氧化,根据化合价变化可得反应的关系式:2MnO4-~5C2O42-,据此计算。
(1)仪器名称是圆底烧瓶;检査装置E气密性的方法是先关闭弹簧夹 ,从滴液漏斗处倒水,若形成一段稳定的水柱,则证明装置气密性好,故答案为:圆底烧瓶;先关闭弹簧夹 ,从滴液漏斗处倒水,若形成一段稳定的水柱,则证明装置气密性好;
(2) Na2O2会与水反应,接A前要干燥,硝酸易挥发,生成的二氧化氮和水反应生成一氧化氮,接C,多余的NO对空气有害,接尾气处理,顺序为h-e-f-c-d-a-b-g,故答案为:e-f-c-d-a-b-g;
(3) NO能被酸性高锰酸钾溶液氧化为NO3-,离子方程式为5NO+3MnO4-+4H+=3Mn2++ 5NO3-+2H2O,故答案为:5NO+3MnO4-+4H+=3Mn2++ 5NO3-+2H2O;
(4) 亚硝酸钠与硫酸反应,生成HNO2,HNO2反应3HNO2=HNO3+2NO+H2O,NO与空气反应,生成二氧化氮,现象为:有气泡产生,液面上方变红,故答案为:有气泡产生,液面上方变红;
(5) NO2-可将MnO4-还原为Mn2+,根据化合价变化可得反应的关系式:2MnO4-~5NO2-,多余的高锰酸钾,可将草酸根氧化,根据化合价变化可得反应的关系式:2MnO4-~5C2O42-,消耗0.001mol·L-1草酸钠115.00mL,消耗高锰酸钾的物质的量为0.001mol·L-1×0.115 L×2/5=4.6×10-5mol,则1000mL水样消耗高锰酸钾的物质的量为0.001mol·L-1×0.05 L-4.6×10-5mol=4×10-6mol,则水样中含有亚硝酸钠的物质的量为4×10-6mol×5/2=10-5mol,质量为10-5mol×69g/mol=6.9×10-4g=0.69mg,所以水中NaNO2的含量为0.69mg/1L=0.69mg/L;NaNO2放置空气中时间过长被氧化,实际含量降低,测定结果偏低,故答案为:0.69mg/L;偏低。