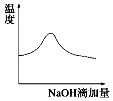
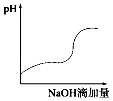
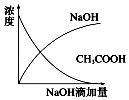
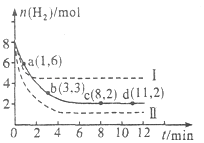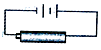��Ŀ����
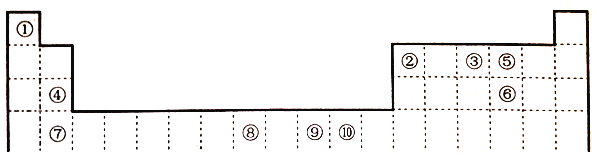
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е��١�������Ԫ�أ���д���пհף�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
��1������ЩԪ���У���ѧ��������õ���______����Ԫ�ط��ţ�����λ��Ԫ�����ڱ��ĵ�____���С�
��2����ЩԪ�ص�����������ˮ�����У�������ǿ�Ļ�����ĵ���ʽ��___________��
��3�����ĵ��ʱ����ĵ����۵�_______�����������������������ܢݢޢ��ļ����Ӱ뾶��С�����˳��Ϊ___________________������ű�ʾ����
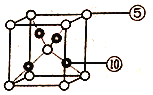
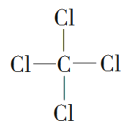
��4���������γɵ�ij�ֻ����ᆳ��������ȡ������ṹʽΪ________���û���������________������������������������������������γɵĵ���ɫ�Ĺ�������������ӵĸ�����Ϊ_______��
��5��Ԫ������Ԫ������ȣ���֤��������Ԫ�طǽ�����ǿ������ʵ��_______����ѡ����ţ���
A�����������ĵ��ʺ����ĵ���״̬��ͬ B�����ļ��⻯������ļ��⻯���ȶ�
C�����⻯��ķе�����>�� D�����ĵ����������ļ��⻯�ﷴӦ���ɢĵ���
���𰸡� Ar 15 ![]() �� ��<��<��<��
�� ��<��<��<��  ���� 1��2 BD
���� 1��2 BD
������������Ԫ�������ڱ��е����λ�������жϳ�Ԫ�����ƣ�Ȼ����Ԫ���������Լ��й����ʵĽṹ�����ʷ������
�ɱ�����Ϣ��֪���٢ڢۢܢݢޢߢ��ֱ����C��N��O��Na��Al��S��Cl��Ar��K��Ԫ�ء���
��1������ЩԪ���У���ѧ��������õ���ϡ������Ԫ��Ar�����ǵ�Ԫ�أ�λ��Ԫ�����ڱ��ĵ�15���С�
��2��������������ˮ�����У�������ǿ�Ļ�������KOH���������Ӽ��ͼ��Լ��������ʽ��![]() ��
��
��3���ƺͼ���ͬһ����Ľ�������۵�������ͬ�������Ӱ뾶��С�����ԣ��ƵĽ�����ǿ�ڼأ����Ƶ��۵�ȼظߣ��ܢݢޢߵļ����ӷֱ���Na+��Al3+��S2-��Cl-��ǰ���ߺ�����2�����Ӳ㣬�����ߺ�����3�����Ӳ㣬���Ӳ�ṹ��ͬ�����ӣ��˵����Խ��İ뾶ԽС�����ԣ��뾶��С����Ϊ�ݣ��ܣ��ߣ��ޡ�
��4��������γɵ�ij�ֻ����ᆳ��������ȡ����Ӧ�������Ȼ�̼������ṹʽΪ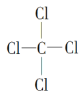 ���û�����ֻ�й��ۼ������ڹ��ۻ����������γɵĵ���ɫ�Ĺ����ǹ������ƣ������������ӷֱ��ǹ��������Ӻ������ӣ������������ӵĸ�����Ϊ1:2��
���û�����ֻ�й��ۼ������ڹ��ۻ����������γɵĵ���ɫ�Ĺ����ǹ������ƣ������������ӷֱ��ǹ��������Ӻ������ӣ������������ӵĸ�����Ϊ1:2��
��5����Ԫ������Ԫ����ȣ���֤��������Ԫ�طǽ�����ǿ������ʵ�У����ļ��⻯�����ļ��⻯���ȶ������ĵ���������ļ��⻯����û���Ӧ�������������ĵ��ʺ���ĵ���״̬��ͬ�����ļ��⻯��ķе����ļ��⻯��ķе�߶�����Ӽ�������������йأ���ǽ������أ����ԣ���֤��������Ԫ�طǽ�����ǿ������ʵ��BD��