题目内容
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
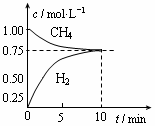
 CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )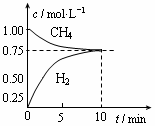
| A.10min时用CH4表示的反应速率为0.075 mol?L-1?min-1 |
| B.使用高效催化剂能够增大CO的产率 |
| C.该条件下反应的平衡常数为0.1875 |
D.升高温度能使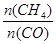 增大 增大 |
C
10min时甲烷浓度的变化量是1.00mol/L-0.75mol/L=0.25mol,所以用CH4表示的反应速率为0.25mol/L÷10min==0.025 mol?L-1?min-1,A错误;使用催化剂只能改变反应速率,但不影响平衡状态,CO的产率不变,B错误;平衡时CH4、H2O、CO、H2的物质的量浓度分别为0.75、0.75、0.25、0.75,所以平衡常数K=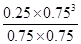 =0.1875,C正确;正反应是吸热反应,所以升高温度,平衡向正方向方向移动,
=0.1875,C正确;正反应是吸热反应,所以升高温度,平衡向正方向方向移动,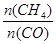 减小,D错误。答案选C。
减小,D错误。答案选C。
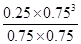 =0.1875,C正确;正反应是吸热反应,所以升高温度,平衡向正方向方向移动,
=0.1875,C正确;正反应是吸热反应,所以升高温度,平衡向正方向方向移动,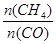 减小,D错误。答案选C。
减小,D错误。答案选C。
练习册系列答案
相关题目
 xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白: N2O4在恒容容器中进行,当体系压强不再发生变化时,反应达到化学平衡状态
N2O4在恒容容器中进行,当体系压强不再发生变化时,反应达到化学平衡状态 CH3OH(g) ΔH1
CH3OH(g) ΔH1 a、容器各物质的浓度保持不变; b、容器内压强保持不变;
a、容器各物质的浓度保持不变; b、容器内压强保持不变;

 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。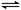 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表: CO2+1/2N2,则100℃时,K的值= 。
CO2+1/2N2,则100℃时,K的值= 。 (g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是
(g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是