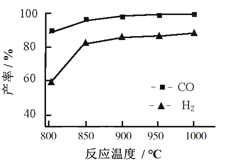
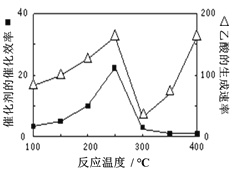
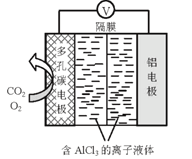
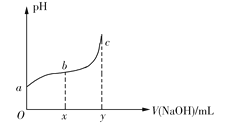
题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
A.x的值是2
B.开始时B的物质的量为3mol
C.5min时,B的物质的量浓度为1.5 mol·L-1
D.5min时,容器中气体总的物质的量为7mol
【答案】B
【解析】
设A、B的起始浓度是的amol/L,5min后C的物质的量浓度为0.1mol·L-1·min-1×5min=0.5mol/L
3A(g)+ B(g)![]() 2D(g) + xC(g)
2D(g) + xC(g)
开始 a a 0 0
转化 0.75 0.25 0.5 0.5mol·L-1
5min末 a-0.75 a-0.25 0.5 0.5mol·L-1
A.化学反应中各物质的变化量比等于系数比,C、D 在5min内的变化量相同,所以 x的值是2,故A正确;
B. 5min后,A、B的物质的量浓度之比为2∶3,则(a-0.75 ):(a-0.25)= 2∶3,a=1.75mol/L,开始时B的物质的量为1.75mol/L ×2L=3.5mol,故B错误;
C. 根据B选项,5min时,B的物质的量浓度为1.75mol/L -0.25 mol/L =1.5 mol/L,故C正确;
D. 根据B选项,反应前加入A、B的物质的量共7mol,反应前后气体系数和相同,所以 5min时,容器中气体总的物质的量为7mol,故D正确;
答案选B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填标号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是_________________。
(3)根据表中数据,计算待测盐酸溶液的浓度为________ mol·L-1。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为__________;加入的指示剂是____________。
(5)步骤②应使用________式滴定管。
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是________。(填标号)
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
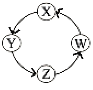
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D