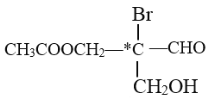题目内容
【题目】甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是

A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
【答案】B
【解析】
甲、乙存在平衡2NO2N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大;但平衡移动的结果是降低NO2浓度的增大,不会消除增大;反应混合气体的总质量不变,总的物质的量减小,混合气体的平均摩尔质量增大;
丙中存在平衡N2O42NO2,相当于开始加入0.2molNO2,与甲为等效平衡,NO2浓度、N2O4的百分含量、混合气体的平均摩尔质量与甲中相同。平衡时甲、丙中N2O4的物质的量相等,平衡时甲中NO2 与丙中N2O4 的转化率之和等于1。
甲、乙存在平衡2NO2N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,丙中存在平衡N2O42NO2,相当于开始加入0.2molNO2,与甲为等效平衡,
A. 甲与丙为完全等效平衡,平衡时NO2浓度的相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,但平衡移动的结果是降低NO2浓度的增大,不会消除增大,故平衡时容器内c(NO2)的大小顺序为乙>甲=丙,故A错误;
B. 甲与丙为完全等效平衡,平衡时N2O4的百分含量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大,故平衡时N2O4的百分含量:乙>甲=丙,故B正确;
C. 甲与丙为完全等效平衡,平衡时甲、丙中N2O4的物质的量相等,平衡时甲中NO2与丙中N2O4的转化率之和等于1,故平衡时甲中NO2 与丙中N2O4 的转化率可能相同,都为0.5,故C错误;
D. 甲与丙为完全等效平衡,平衡时混合气体的平均摩尔质量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,总的物质的量减小,乙中平均摩尔质量增大,故平衡时混合物的平均相对分子质量:乙>甲=丙,故D错误;
答案选B。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3molL-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO | SO | NO | NO | Cl- |
c/(molL-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___。增加压强,NO的转化率___(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___ (填“增大”、“不变”或“减小”)。
③由实验结果可知,脱硫反应速率脱硝反应速率___ (填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。
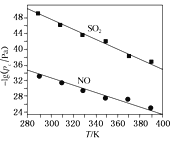
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___ (填“增大”、“不变”或“减小”)。
②反应ClO![]() +2SO
+2SO![]() =2SO
=2SO![]() +Cl-的平衡常数K表达式为___。
+Cl-的平衡常数K表达式为___。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
2mL1mol/LBaCl2溶液 4mL1mol/LNaHCO3溶液 | 2mL1mol/LBaCl2溶液 4mL1mol/LNa2SO3溶液 | 2mL1mol/LBaCl2溶液 4mLH2SO3溶液 |
A.实验①中生成的沉淀是BaCO3
B.实验①中有气体生成
C.实验②沉淀中可能含有BaSO4
D.实验③生成沉淀的离子方程式是:Ba2++H2SO3=BaSO3↓+2H+