题目内容
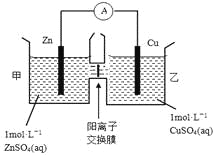
【题目】观察如图,回答问题:

(1)该装置叫__装置,可以将__能转化为__能。
(2)负极是__,电极反应式为__。
(3)正极是__,电极反应式为__。
(4)电池总反应的离子方程式为__。
【答案】原电池 化学 电 铁(Fe) Fe-2e-=Fe2+ 铜(Cu) Cu2++2e-=Cu Fe+Cu2+=Cu+Fe2+
【解析】
该装置为原电池,可将化学能转化为电能。根据两极金属相对活动性可确定铁为负极,铜为正极;负极金属本身失去电子,发生氧化反应:Fe-2e-=Fe2+;溶液中的阳离子在正极上得电子,发生还原反应:Cu2++2e-=Cu。正、负极反应式相加,可得电池总反应的离子方程式为Fe+Cu2+=Cu+Fe2+。
(1)装置没有外接电源,故为原电池,将化学能转化为电能,
故答案为:原电池;化学;电;
(2)铁比较活泼,负极是铁电极,电极方程式为Fe-2e-=Fe2+,
故答案为:铁,Fe-2e-=Fe2+;
(3)正极是铜电极,电极方程式为Cu2++2e-=Cu,
故答案为:铜,Cu2++2e-=Cu;
(4)将正负极电极方程式相加得电池总反应的离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+Cu2+=Cu+Fe2+

【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%