题目内容
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示: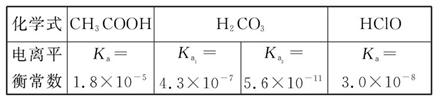
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是 (用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
| A.c(H+) |
| B.c(H+)/c(CH3COOH) |
| C.c(H+)·c(OH-) |
| D.c(OH-)/c(H+) |
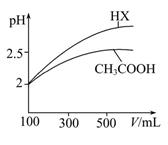
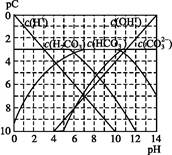
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。
(1)a<d<c<b
(2)B、D
(3)大于 稀释相同倍数,一元酸HX的pH变化比CH3COOH的pH变化大,故HX酸性较强,电离平衡常数较大
解析

工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显_______性,试解释原因__________________________;
②在NaHSO3溶液中离子浓度关系不正确的是_______(填序号)。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+ c(H+)=c(SO32-)+c(OH-)
D.c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下:
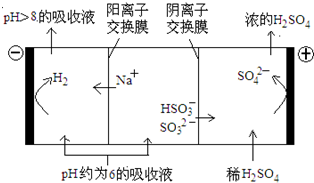
①写出阳极上发生的电极反应式____________;
②当电极上有1mol电子转移时阴极产物的质量为__________。
 H++HA-,HA-
H++HA-,HA- CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
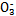 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 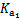 ≈ 。
≈ 。 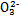 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确