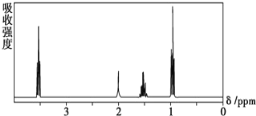
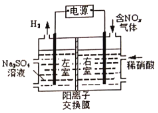
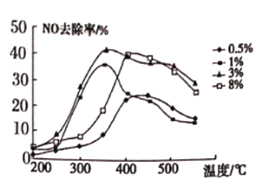
题目内容
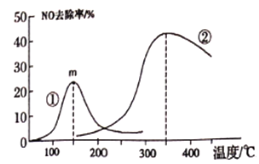
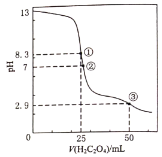
【题目】25℃时,用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.滴定过程中可能出现:![]()
D.点③所示溶液中:![]()
【答案】C
【解析】
用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液,反应为H2C2O4+2NaOH=Na2C2O4+2 H2O、H2C2O4+ Na2C2O4=2 NaHC2O4;
A. 点①pH=8.3时,反应生成Na2C2O4,根据电荷守恒进行判断;
B. 点②pH=7,溶液呈中性,c(H+)= c(OH-),再结合电荷守恒进行判断;
C. 滴定过程中点①溶液呈碱性,点②溶液呈中性,点③溶液呈酸性,据此进行判断;
D. 点③溶液呈酸性,溶质为NaHC2O4,据此判断。
用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液,反应为H2C2O4+2NaOH=Na2C2O4+2 H2O、H2C2O4+ Na2C2O4=2 NaHC2O4;
A. 点①pH=8.3时,反应生成Na2C2O4, C2O42-水解生成HC2O4-、H2C2O4,根据电荷守恒有c(Na+)+ c(H+)= 2c(C2O42-)+c(HC2O4-)+ c(H2C2O4)+ c(OH-),根据物料守恒有c(Na+)= 2c(C2O42-)+2c(HC2O4-)+ 2c(H2C2O4),两式结合得c(OH-)= 2 c(H2C2O4) +c(HC2O4-) +c(H+),A项错误;
B. 点②pH=7,溶液呈中性,c(H+)= c(OH-),根据电荷守恒c(Na+)+ c(H+)= 2c(C2O42-)+c(HC2O4-)+c(OH-),可知![]() ,B项错误;
,B项错误;
C. 滴定过程中点①溶液呈碱性,点②溶液呈中性,点③溶液呈酸性,随着草酸的滴入,NaHC2O4逐渐增多,有![]() ,C项正确;
,C项正确;
D. 点③溶液呈酸性,溶质为NaHC2O4,HC2O4-电离程度大于水解程度,故有![]() ,D项错误;
,D项错误;
答案选C。