��Ŀ����
����Ŀ����.��ⷨ��������������������ɻ������ᡣʵ����ģ���ⷨ����NOx��װ������ͼ��ʾ��ͼ�е缫��Ϊʯī�缫��������NO2�������ģ���ⷨ����ʵ�顣

��д�����ʱNO2������Ӧ�ĵ缫��Ӧʽ��________��
�����б�״����2.24L NO2�����գ�ͨ�������ӽ���Ĥ��ֻ����������ͨ������H+Ϊ___mol��
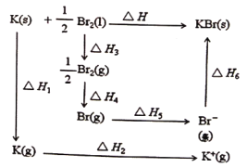
��.����β�������������������Ҫԭ��֮һ����֪����β���ŷ�ʱ���������·�Ӧ����![]() ��H1=+180kJ��mol-1����
��H1=+180kJ��mol-1����![]() ��H2����
��H2����![]() ��H3����֪��CO��O2��Ӧ��صĻ�ѧ�����ܼ����������£�
��H3����֪��CO��O2��Ӧ��صĻ�ѧ�����ܼ����������£�

��1���������ϰ�װ��Ԫ��ת������ʵ�ַ�Ӧ�ۣ���÷�Ӧ��________������¡����»��κ��¶ȣ������Է����С�
��2��Ϊ�о��¶ȡ������������Ͳ�ͬ������NOȥ���ʵ�Ӱ�졣��NO��CO��һ��������ͨ����ͬ�Ĵ������з�Ӧ������ͬʱ���ڲ����ݳ�������NO�ĺ������Ӷ�ȷ��β���ѵ��ʣ��ѵ��ʼ�NO��ת���ʣ���ͼ1�Dz�ͬ��������Cu2+ʵ������ͼ2�Dz�ͬ������ʵ������������ָ3%Co2+��������ָ3%Cu2+����
ͼ1  ͼ2
ͼ2 
����˵������ȷ����________
A. ͼ1˵��Cu2+����Խ���ѵ�Ч��Խ��
B. ͼ1˵��Cu2+3%�Ĵ�����350�������ѵ�Ч�����
C. ͼ2˵���ڢ��ִ����ȵڢ��ִ����ѵ��ʸ�
D. ͼ2˵��m����ƽ���
��3����ij�¶��£�2L�ܱ������г���NO��CO��0.4mol���з�Ӧ�ۣ����NO���ʵ����仯��ͼ��ʾ��5����ĩ��Ӧ�ﵽƽ�⣬�÷�Ӧ��ƽ�ⳣ��K=____����6���Ӽ�������0.2mol NO��0.2mol CO��0.2mol CO2��0.3mol N2��������ͼ�л�����9����ĩ��Ӧ�ﵽƽ��NO�����ʵ�����ʱ��ı仯����____��

���𰸡�NO2-e-+H2O=NO3-+2H+ 0.1 ���� ACD 5 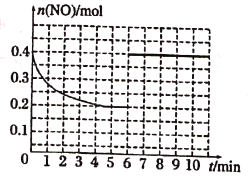
��������
��. ����ͼ��֪���أ�����A�缫��H+�ŵ�����H2��Ϊ����������B�缫Ϊ����������ͨ��NOx���������ᣬ��д���缫��Ӧ��
���б�״����2.24L NO2�����գ����ݵ缫��Ӧ���м��㣻
��.��1�����ݸ�˹���ɿ�֪2��H2-��H1=��H3���֦�H=��Ӧ����ܼ���-��������ܼ��ܣ������Է����еķ�Ӧ��G��0���з�����
��2��ͼ��Cu2+3%�Ĵ�����350������Ч����ߣ�ͼ2�д���ֻӰ�췴Ӧ���ʣ�ת���ʲ��ᷢ���仯����ߵ����������ߣ��ݴ��жϣ�
��3���������η����л����ļ��㣬�ٸ��ݼ�������ͼ��
��. ����ͼ��֪���أ�����A�缫��H+�ŵ�����H2��Ϊ����������B�缫Ϊ����������ͨ��NOx���������ᣬ�缫��ӦΪ��NO2-e-+H2O=NO3-+2H+��
���б�״����2.24L NO2�����գ�����NO2-e-+H2O=NO3-+2H+��֪����0.2mol H+������0.1mol H+�����������ᣬ���ͨ�������ӽ���Ĥ��H+Ϊ0.1mol��
��. ��1�����ݸ�˹���ɿ�֪2��H2-��H1=��H3���֦�H=��Ӧ����ܼ���-��������ܼ���=1072kJ/mol+![]() ��497 kJ/mol-2��803 kJ/mol=-285.5 kJ/mol����H��0����S��0���Է����еķ�Ӧ��G=��H-T��S��0��֪��Ӧ�ڵ����½��У�
��497 kJ/mol-2��803 kJ/mol=-285.5 kJ/mol����H��0����S��0���Է����еķ�Ӧ��G=��H-T��S��0��֪��Ӧ�ڵ����½��У�
��2��A. ����ͼ1��֪Cu2+����Խ�ߣ��ѵ�Ч����һ��Խ�ã�A�����
B. ����ͼ1��֪Cu2+3%�Ĵ�����350������Ч����ߣ�B����ȷ��
C. ����ֻӰ�췴Ӧ���ʣ�ת���ʲ��ᷢ���仯���ʴ����ںʹ����ٶ�ת������Ӱ�죬C�����
D.��ߵ����������ߣ���ƽ��ת�����أ�D�����
��ѡACD��
��3������ɿɵ�
2CO(g) + 2NO(g) = N2(g) +2CO2(g)
ʼ(mol/L) 0.2 0.2 0 0
ת(mol/L) 0.1 0.1 0.05 0.1
ƽ(mol/L) 0.1 0.1 0.05 0.1
ƽ�ⳣ��K=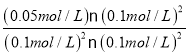 =5��
=5��
��6���Ӽ�������0.2mol NO��0.2mol CO��0.2mol CO2��0.3mol N2����c(CO)=![]() =0.2mol/L��c(NO)=
=0.2mol/L��c(NO)=![]() =0.2mol/L��c(N2)=
=0.2mol/L��c(N2)=![]() =0.2mol/L��c(CO2)=
=0.2mol/L��c(CO2)=![]() =0.2mol/L��Qc=
=0.2mol/L��Qc=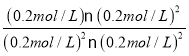 =5=K������Ӧ��Ϊƽ��״̬����NO�����ʵ�����ԭ����2������ͼΪ
=5=K������Ӧ��Ϊƽ��״̬����NO�����ʵ�����ԭ����2������ͼΪ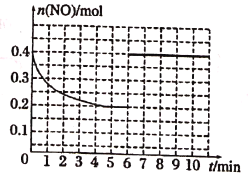 ��
��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�