题目内容
【题目】在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极距(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是____。
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,三种分子的偶极矩由大到小的排列顺序是________。
(3)实验测得:μ(PF3)=1.03德拜;μ(BCl3)=0。由此可知,PF3分子是____构型,BCl3分子是____构型。
(4)冶癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体。棕黄色者μ>0,淡黄色者μ=0。试画出两种异形体的构型图。
构型图:淡黄色____________________,棕黄色____________________。
【答案】 CS2 邻>间>对。 三角锥形 平面三角形。 
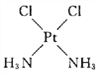
【解析】试题分析:(1)HCl是极性键形成双原子的极性分子,CS2是直线形分子,其偶极矩为0;H2S、SO2中都是V形,即极性分子;(2)根据分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=dq分析;(3)μPF3=1.03说明PF3是极性分子,不是非极性分子,μBCl3=0说明 BCl3是非极性分子;(4)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,即正负电荷重心重合;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合;
解析:(1)HCl是极性键形成双原子的极性分子.根据价层电子对互斥模型可知,CS2是直线形分子,即非极性分子,其偶极矩为0;H2S、SO2中都是V形,即极性分子,其 μ>0.故 μ=0的是CS2;(2)分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=dq,对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的d由大到小的排列顺序是:邻>间>对,素以偶极矩关系是邻>间>对;(3)μPF3=1.03说明PF3是极性分子,不是非极性分子,即PF3是三角锥形而不是正三角形,μBCl3=0说明 BCl3是非极性分子,其正负电荷重心重合,应该是平面正三角形;(4)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,即正负电荷重心重合,故淡黄色者是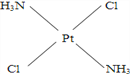 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是
;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是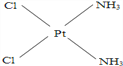 。
。