【题目】溴化亚铜(CuBr)常用作有机合成原料和反应催化剂等,它是一种不溶于水的白色结晶粉末,受热或见光易分解,接触空气会被缓慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1:在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO22小时。
步骤2:溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3:依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4:将获得的产品经系列干燥剂干燥后,再进行真空干燥。

请根据上述制备步骤回答有关问题:
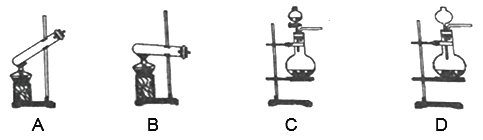
(1)制备中用到的SO2在实验室中通常是用浓硫酸和亚硫酸钠为原料来制备的,在制备SO2时装置可以选择下图中的____________(填装置编号),发生反应的化学方程式为____________。
(2)步骤1中:①所用蒸馏水需提前煮沸处理,这样做的目的是____________。
②为控制反应在60℃进行可采取的措施是________________。
③三颈烧瓶中反应生成CuBr的离子方程式为_____________。
④判断反应已经完成的现象是______________。
(3)步骤2在过滤时需要避光的原因是___________。
(4)步骤3中用到的洗涤剂水、乙醇中均“溶有少量SO2”的原因是____________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。需用到以下试剂:SO2(贮存在钢瓶中)、100g20%NaOH溶液、乙醇等。请将下列实验步骤补充完整。
①向烧杯中继续通入SO2至溶液饱和;②____________;③加入少量维生素C溶液(抗氧化剂),蒸发浓缩,冷却结晶;④______________;⑤放真空干燥箱中干燥。