题目内容
【题目】高铁酸钾的生产流程如图,涉及的离子反应方程式书写错误的是( )
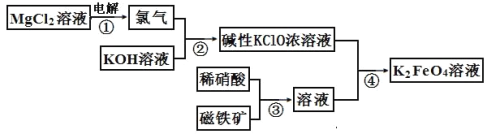
A. 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. Cl2+2OH-=Cl-+ClO-+H2O
C. 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
【答案】A
【解析】
A、氯化镁溶液电解:MgCl2+2H2O![]() Cl2↑+H2↑+Mg (OH)2↓,离子反应方程式:Mg2+ +2Cl-+2H2O
Cl2↑+H2↑+Mg (OH)2↓,离子反应方程式:Mg2+ +2Cl-+2H2O![]() Cl2↑+H2↑+Mg (OH)2↓ ,Mg (OH)2是难溶物,不可拆,A错误;
Cl2↑+H2↑+Mg (OH)2↓ ,Mg (OH)2是难溶物,不可拆,A错误;
B、氯气和氢氧化钾溶液反应:Cl2+2KOH=KCl+KClO+H2O,离子反应方程式:Cl2+2OH-=Cl-+ClO-+H2O,B正确;
C、磁铁矿和稀硝酸反应:3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O,离子反应方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,C正确;
D、碱性KClO溶液与Fe(NO3)3溶液反应:3KClO+2Fe(NO3)3+10KOH=2K2FeO4+3KCl+5H2O+ 6KNO3,离子反应方程式:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,D正确。
答案选A。

【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
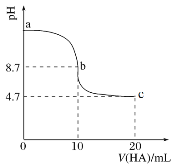
① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)