题目内容
(12分)测定硫酸铝晶体样品中Al2(SO4)3·18H2O(M=666g/mol)质量分数的实验步骤为(物质EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应):
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、 。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、 。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。
⑴100 mL容量瓶、胶头滴管(4分)
⑵ (4分)
(4分)
⑶0.2mol·L-1 (4分)
⑵
 (4分)
(4分)⑶0.2mol·L-1 (4分)
试题分析:(1)稀释定容时需要的仪器有“容量瓶、烧杯、玻璃棒、胶头滴管、量筒”。
(2)整个过程中发生的反应可用如下关系式表示:
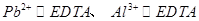 ,由此可知该样品中Al2(SO4)3·18H2O的质量分数
,由此可知该样品中Al2(SO4)3·18H2O的质量分数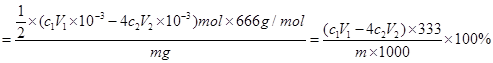 。
。(3)可知发生反应的关系式为:
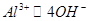 ,因此溶液中
,因此溶液中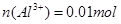 ,因此步骤1溶液中硫酸铝的物质的量浓度
,因此步骤1溶液中硫酸铝的物质的量浓度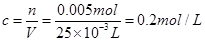
点评:本题属于基础题,主要考查滴定过程中涉及的计算问题。在计算过程中,应注意守恒定律的应用;同时,利用化学方程式中的关系式,可以节省解题时间。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目

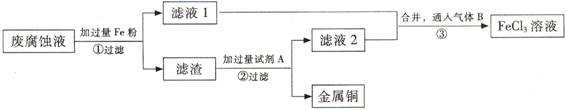 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式