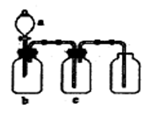
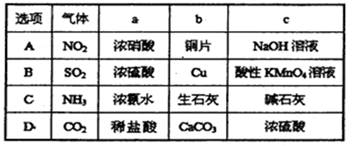
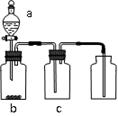
题目内容
取少量Fe2O3粉末(红褐色)加入适量盐酸,化学反应方程式为: ,得到棕黄色的FeCl3溶液,用此溶液分别做如下实验:在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得 ,用激光笔照射烧杯中的液体,可以观察到液体中出现 ,这个现象叫 。
.(共5分)Fe2O3 + 6H+ =2Fe3++3H2O;(2分)
Fe(OH)3 胶体;光亮的通路;丁达尔现象。(每空1分)
Fe(OH)3 胶体;光亮的通路;丁达尔现象。(每空1分)
试题分析:氧化铁是碱性氧化物,能和盐酸反应,方程式是Fe2O3 + 6H+ =2Fe3++3H2O;在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得氢氧化铁胶体,用激光笔照射烧杯中的液体,可以观察到液体中出现光亮的通路,这个现象叫丁达尔效应。
点评:该题是基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固和训练。有助于培养学生的应试能力,提高学生分析问题、灵活运用基础知识解决实际问题的能力。该题难度不大,学生记住即可得出正确的结论。

练习册系列答案
相关题目