题目内容
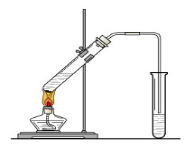
(12分)某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.回答下列问题:

(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有Na2CO3溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。
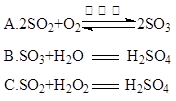
(5)浓硫酸有许多重要性质,在与含有水分的蔗糖作用过程中不能显示的性质是

(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有Na2CO3溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。
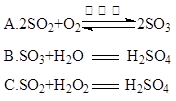
(5)浓硫酸有许多重要性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
(12分)(1)Cu+2H2SO4(浓) CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
(2)蘸有品红溶液的滤纸褪色 ,滤纸变红
(3)吸收多余SO2,防止污染空气 (4)A B (5)A
 CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O(2)蘸有品红溶液的滤纸褪色 ,滤纸变红
(3)吸收多余SO2,防止污染空气 (4)A B (5)A
试题分析:(1)在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)
 CuSO4+ SO2↑+2H2O。
CuSO4+ SO2↑+2H2O。(2)硫酸的还原产物SO2具有漂泊性,能使品红溶液褪色。但SO2的漂白是不稳定的,在加热的情况下,可以恢复到用来的颜色,所以滤纸条又恢复红色。
(3)SO2是大气污染物,因此蘸有Na2CO3溶液的棉花团作用是吸收多余SO2,防止污染空气。
(4)空气中的SO2被氧化生成SO3,SO3溶于水生成硫酸,即形成酸雨,答案选AB。
(5)浓硫酸具有脱水性、吸水性和强氧化性。可以使蔗糖炭化,进而氧化生成CO2、SO2和水,所以在该变化过程中,没有体现硫酸的酸性,答案选A。2的检验和尾气处理
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,有利于考查学生能力,也有利于培养学生的实验探究、分析以及逻辑推理能力。同时也有利于培养学生的环境保护意识,增强学生的社会责任感。

练习册系列答案
相关题目