题目内容
按要求完成以下方程式:
(1)磁性氧化铁溶于盐酸的化学方程式:_________________________________________。
(2)氯化铁溶液中通入SO2气体的离子方程式:_______________ ____________________。
(3)偏铝酸钠溶液中通入过量CO2的离子方程式:_________________________________。
(4)碳单质和浓硝酸反应的化学方程式:_________________________________________。
(8分)(1)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
(2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(3)AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-
(4)C +4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
解析试题分析:磁性氧化铁就是四氧化三铁,溶于盐酸生成氯化铁和氯化亚铁以及水;铁离子具有氧化性,能把SO2氧化生成硫酸;碳酸的酸性强于偏铝酸的,但偏铝酸的酸性强于碳酸氢钠的,所以偏铝酸钠溶液中通入过量CO2生成的是氢氧化铝和碳酸氢钠;浓硝酸具有强氧化性,能把碳氧化生成CO2,而浓硝酸的还原产物是NO2。
考点:考查常见方程式的书写

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
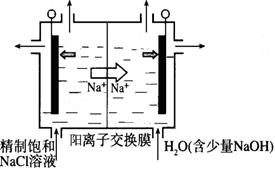
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2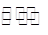 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c
(Cl-)=0.3mol/L。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
| A.原溶液的浓度约为0.13mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br-)= 0.4mol/L |

 Cr2O72-
Cr2O72-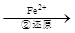 Cr3+
Cr3+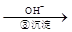 Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O