题目内容
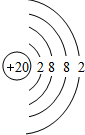
20.某元素的核素AzX.其氯化物XCl21110mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀.已知该核素中的质子数和中子数相等.试回答下列问题:(1)X元素的原子序数为20,原子结构示意图为
 ;
;(2)用电子式表示出XCl2的形成过程
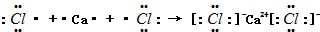 ;
;(3)将X的单质放入含有酚酞的水中,现象是有气体产生,溶液变红;写出该反应的化学方程式Ca+2H2O═Ca(OH)2+H2↑.
分析 由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,则n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,则M(XCl2)=$\frac{1.11g}{0.01mol}$=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,据此解答.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,则M(XCl2)=$\frac{1.11g}{0.01mol}$=111g/mol,所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,质子数=质量数-中子数=40-20=20,故X为Ca元素,其原子结构示意图为: ,故答案为:20;
,故答案为:20; ;
;
(2)CaCl2属于离子化合物,用电子式表示CaCl2的形成过程为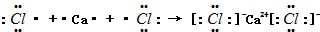 ,
,
故答案为: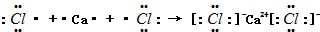 ;
;
(3)Ca水剧烈反应生成Ca(OH)2和H2,溶液呈碱性,故现象为:有气体产生,溶液变红,该反应化学方程式为:Ca+2H2O═Ca(OH)2+H2↑,
故答案为:有气体产生,溶液变红;Ca+2H2O═Ca(OH)2+H2↑.
点评 本题考查离子方程式的计算、结构性质位置关系应用、常用化学用语等,难度不大,注意掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
相关题目
11.烷基取代苯  可以被KMnO4的酸性溶液氧化生成,
可以被KMnO4的酸性溶液氧化生成, ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为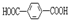 的异构体有( )
的异构体有( )
 可以被KMnO4的酸性溶液氧化生成,
可以被KMnO4的酸性溶液氧化生成, ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为 的异构体有( )
的异构体有( )| A. | 13种 | B. | 14种 | C. | 15种 | D. | 16种 |
5.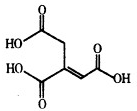 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
6.下列各组有机物的同分异构体数目相等的是(不考虑立体异构)( )
| A. | C5H12和C4H8 | B. | C4H10和C3H8O | C. | C3H4和C4H9Cl | D. | C3H7Br和C2H6O |
4.下列关于元素性质的有关叙述中不正确的是( )
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
 .Q的离子符号为OH-.
.Q的离子符号为OH-. +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ +HBr
+HBr
 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+
 .
.