题目内容
【题目】取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
A. 温度越高,镁与水反应的速率越快
B. 镁与水反应的化学方程式为:Mg+2H2O = Mg(OH)2+H2↑
C. 氢氧化镁显碱性,且在水中有一定的溶解性
D. 氢氧化镁是离子化合物,它的电子式可表示为:![]()
【答案】D
【解析】
A、温度越高,反应速率越快,A正确;
B、镁是活泼金属,在加热条件下与水反应,反应的方程式为Mg+2H2O═Mg(OH)2+H2↑,B正确;
C、滴加酚酞后,镁带附近溶液变红色,说明氢氧化镁显碱性,且在水中有一定的溶解性,故C正确;
D、氢氧化镁是离子化合物,电子式中应出现[],并带有电荷,D错误。

 名校课堂系列答案
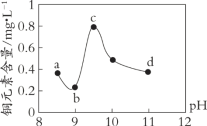
名校课堂系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升