题目内容
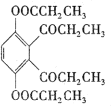
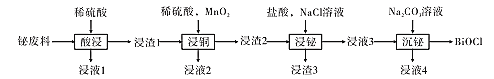
【题目】氯氧化铋(BiOCl)常用于电子设备等领域,BiOCl难溶于水,它是BiCl3的水解产物。以铋的废料(主要含铋的化合物,含少量铜、铅、锌的硫酸盐及Cu2S和Fe2O3等)为原料生产高纯度BiOCl的工艺流程如下:
请回答下列问题:
(1)在浸液1中加入过量的锌,过滤,将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥得结晶水合物M,M的摩尔质量为287 g·mol-1,M为 ___(填化学式)。
(2)已知:浸液2呈蓝色,浸渣2含有少量硫单质。“浸铜”中MnO2的作用是____(用离子方程式表示)。
(3)“浸铋”中,铋的浸出率与温度关系如图所示:
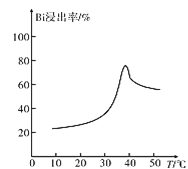
在高于40℃左右时“铋浸出率”开始下降,其主要因素可能是____(从两个角度分析)。
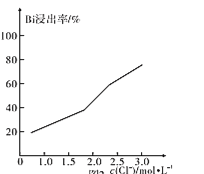
(4)在室温和液固比固定的条件下,c(HCl)=1.0mol·L-1时,铋的浸出率与溶液中c(Cl-)的关系如图所示。“浸铋”操作中,加入NaCl的目的是____。
(5)浸液3中主要溶质是BiCl3,“沉铋”过程中,有气体放出。“沉铋”的主要化学反应的方程式为____。从绿色化学角度看,浸液4可以用于____(填“酸浸”、“浸铜”或“浸铋”)。
(6)测定产品的纯度:取mg充分洗涤并干燥后的产品,溶于稍过量的浓硝酸中,加水稀释到100.0mL,取20.0mL于烧杯中,用cmol·L-1的AgNO3标准溶液滴定至终点(用Na2CrO4,作指示剂),消耗AgNO3标准溶液VmL,则产品中BiOCl的质量分数为____%(用含m、c、V的代数式表示)。
【答案】ZnSO4·7H2O Cu2S+2MnO2+8H+=2Cu2++S+2Mn2++4H2O HCl的挥发加快、Bi3+水解程度增大 增大浸出液中c(Cl-)提高铋浸出率 BiCl3 + Na2CO3=BiOCl↓+ 2NaCl + CO2↑ 浸铋 ![]()
【解析】
铋废料加入稀硫酸酸浸,浸液1中主要含Cu2+、Zn2+、Fe3+等,浸渣1中则主要含有铋的化合物、Cu2S和PbSO4;向浸渣1中加入稀硫酸和MnO2,根据题目信息可知亚铜离子被氧化得到Cu2+,S2-被氧化得到S单质,所以浸渣2中主要含有含铋化合物、S和PbSO4;向浸渣2中加入盐酸和NaCl溶液可以浸出Bi3+,酸性溶液中铋元素主要以Bi3+形式存在,所以浸液3中主要含有Bi3+,浸渣3主要为S和PbSO4;浸液3中加入Na2CO3溶液,溶液碱性增强,Bi3+水解以BiO+离子形式存在,BiO+与Cl-形成BiOCl从溶液中析出,最终得到BiOCl,据此分析解答。
(1)浸液1中主要阳离子为Cu2+、Zn2+、Fe3+等,加入过量锌,Cu2+、Fe3+完全反应,得到纯净的硫酸锌溶液,所以最终得到的结晶水合物为ZnSO4·xH2O,其摩尔质量为287 g·mol-1,则x=![]() ,所以M为ZnSO4·7H2O;
,所以M为ZnSO4·7H2O;
(2)浸液2为蓝色,说明有铜离子生成,即Cu+被MnO2氧化,浸渣2含有少量硫单质,即硫离子被氧化成硫单质,结合电子守恒和元素守恒可知该过程离子方程式为Cu2S+2MnO2+8H+=2Cu2++S+2Mn2++4H2O;
(3)温度升高HCl 的挥发加快、Bi3+水解程度增大,导致高于40℃左右时“铋浸出率”开始下降;
(4)据图可知氯离子浓度越大,铋的浸出率增大,加入氯化钠可以增大浸出液中c(Cl-),提高铋浸出率;
(5)BiCl3的水解使溶液显酸性,碳酸钠水解使溶液显碱性,二者相互促进,最后彻底水解,所以得到的气体应为二氧化碳,发生的反应方程式为:BiCl3 + Na2CO3= BiOCl↓+ 2NaCl + CO2↑;根据方程式可知浸液4中含有大量NaCl,可用于浸铋;
(6)该滴定原理为利用硝酸银标准液滴定BiOCl中氯离子的量,存在数量关系n(BiOCl)=n(AgNO3);所以20.0mL待测液中n(BiOCl)=Vc×10-3mol,则样品中n(BiOCl)=![]() ×Vc×10-3mol=5Vc×10-3mol,所以产品中BiOCl的质量分数为
×Vc×10-3mol=5Vc×10-3mol,所以产品中BiOCl的质量分数为![]() 。
。

【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
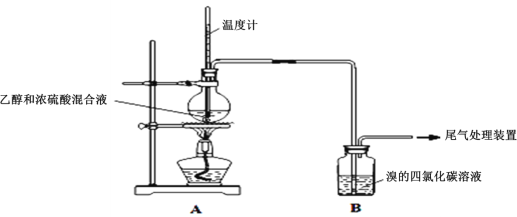
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
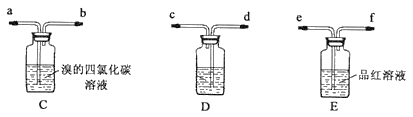
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
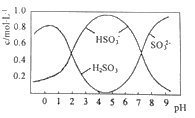
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。