题目内容
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
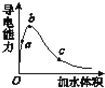
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
【答案】黄 加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42—)增大,c(Cr2O72—)减小 橙 加入适量的稀硫酸,使c(H+)增大,平衡左移,c(CrO42—)减小,c(Cr2O72—)增大 x2>x1>x3 y2>y1=y3 c>b>a b 10-6 BC
【解析】
Ⅰ.(1)加入少量NaOH固体,中和了氢离子,氢离子浓度降低,据此分析判断;
(2)加入酸,H+浓度增大,据此分析判断;
Ⅱ.(1)盐酸是一元强酸,硫酸是二元强酸,完全电离,醋酸是一元弱酸,不能完全电离,据此分析判断;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,与NaOH反应生成盐的物质的量相同,据此分析判断;
(3)①醋酸是弱电解质,加水稀释,促进醋酸电离;导电能力越强,说明溶液中的离子浓度越大;②电离平衡常数Ka=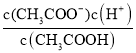 进行计算;③加水稀释,促进醋酸电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此分析判断。
进行计算;③加水稀释,促进醋酸电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此分析判断。
Ⅰ.(1)加入少量NaOH固体,中和了氢离子,氢离子浓度降低,Cr2O72-+H2O![]() 2CrO42-+2H+平衡向右移动,溶液呈黄色,故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42-)增大,c(Cr2O72-)减小;
2CrO42-+2H+平衡向右移动,溶液呈黄色,故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO42-)增大,c(Cr2O72-)减小;
(2)加入过量稀硫酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙色,故答案为:橙红;加入适量的稀硫酸,使c(H+)增大,平衡左移,c(CrO42-)减小,c(Cr2O72-)增大;
Ⅱ.(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离,醋酸是一元弱酸,不能完全电离,所以浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液中,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,所以![]() x1=x2>x3(或x2>x1>x3),故答案为:
x1=x2>x3(或x2>x1>x3),故答案为:![]() x1=x2>x3(或x2>x1>x3);
x1=x2>x3(或x2>x1>x3);
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,所以其与NaOH反应生成盐的物质的量相同,但硫酸为二元酸,消耗的氢氧化钠的体积为其余两种酸的体积的2倍,即y2>y1=y3(或y2=2y1=2y3)故答案为:y2>y1=y3(或y2=2y1=2y3);
(3)①醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,根据图像知,水的体积越大,溶液的浓度越小,醋酸的电离程度越大,所以醋酸电离程度大小顺序是c>b>a;溶液的导电能力与离子浓度成正比,所以溶液导电能力越大氢离子浓度越大,则氢离子浓度最大的为b,故答案为:c>b>a;b;
②经实验测得c点处:c(CH3COOH)=0.01molL-1,c(CH3COO-)=0.0001molL-1,则该条件下CH3COOH的电离常数Ka=![]() =1.0×10-6 mol/L,故答案为:1.0×10-6;
=1.0×10-6 mol/L,故答案为:1.0×10-6;
③A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;B.在稀释过程中,溶液的体积增大,氢离子的浓度减小,溶液pH增大,故B正确;C.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则 增大,故C正确;D.醋酸的浓度越小,电离程度越大,平衡向右移动,CH3COOH分子数减少,故D错误;故答案为:BC。
增大,故C正确;D.醋酸的浓度越小,电离程度越大,平衡向右移动,CH3COOH分子数减少,故D错误;故答案为:BC。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】下列有关实验操作、现象、解释或结论都正确的是![]()
![]()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 等体积 | HX放出的氢气多 | HX酸性比HY弱 |
B | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 向紫色石蕊试液中持续长时间通入氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
A.AB.BC.CD.D
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |