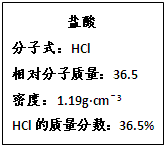
题目内容
(7分)欲测定某生铁(主要成分是铁,还含有少量的碳)的组成,进行了如下实验:称取粉末状样品8.50克,加入某浓度的盐酸100 mL ,充分反应后,收集到标准状况下气体2.24 L ;然后,继续往样品中加入同浓度的盐酸100mL ,充分反应后又收集到标准状况下气体1.12 L 。
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度。(2)该生铁样品中碳的质量分数(保留3位有效数字)。
(1) 2mol/L (2) 98.8﹪
解析试题分析:Fe+2HCl=FeCl2+ H2↑.由于前后两次加入的盐酸物质的量相等,放出的气体体积第二次少,说明又放出气体1.12L后生铁中的Fe已经反应完全,盐酸过量。则第一次是Fe过量,盐酸不足量。根据化学方程式可知:n(HCl)="2" n(H2)="2×(2.24L÷22.4L/mol)=0.2mol.C(HCl)=n/V=0.2mol." ÷0.1L="2mol/L." n(H2)总=3.36L÷22.4L/mol=0.15mol.。n(Fe)= n(H2)=" 0.15mol.,m(Fe)=n·M=0.15mol×56g/mol=8.40g." 所以该生铁样品中碳的质量分数为:(8.40g÷8.50g) ×100﹪=98.8﹪.
考点:考查反应物有过量时的计算及混合物中物质含量的计算的知识。

(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
| KOH | O3 | A | KOH·H2O | 气体密度 |
| 16.8 g | 0.3 mol | a g | b g | >1.429 g/L |
| 16.8 g | 0.2 mol | a g | b g | 1.429 g/L |
A会缓慢分解产生一种钾的氧化物和O2。试确定A的化学式: 。
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③数据可靠。通过计算,分析和比较上表3组数据,给出结论。
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
(2)每一等份的混合物粉末中铜的质量。