题目内容
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: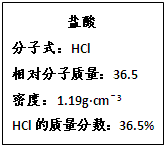
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
(8分)(1)11.9 mol/L(2分) (2)1.5mol/L (3分) (3)56L(3分)
解析试题分析:(1)根据c= 可知,该盐酸的浓度c=
可知,该盐酸的浓度c= mol/L=11.9mol/L.
mol/L=11.9mol/L.
(2)1mol KMnO4恰好和盐酸全部完全反应,则:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 2mol 2mol 5mol
1mol 1mol 1mol 2.5mol
则反应后溶液中Cl-的浓度=(1mol+1mol×2)÷2L=1.5mol/L
(3)生成氢气在标准状况下的体积为2.5mol×22.4L/mol=56L
考点:考查氧化还原反应和物质的量浓度的有关计算

练习册系列答案
相关题目
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5,密度:1.19 g·cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为__ ____mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取___ _____mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面 ( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ( )
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
 CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。