题目内容
20.6.5g锌与1 mol•L-1 足量的盐酸反应,最终得到500mL溶液M,则溶液M中c(Zn2+)=0.2mol/L.分析 根据n=$\frac{m}{M}$计算出6.5g锌的物质的量,再根据反应方程式Zn+2H+═Zn2++H2↑得出锌离子的物质的量,最后根据c=$\frac{n}{V}$计算出锌离子的物质的量浓度.
解答 解:6.5克锌的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,根据反应Zn+2H+═Zn2++H2↑可知,0.1mol锌完全反应生成0.1molZn2+,
则反应后溶液中c(Zn2+)=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题有利于提高学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
10.六六六即六氯环己烷(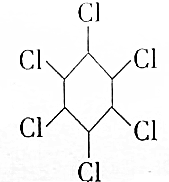 ),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
 ),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )| A. | 六氯环己烷分子中的C原子都是采取sp3杂化 | |
| B. | 六氯环己烷分子中所有C原子共平面 | |
| C. | 六氯环己烷分子中所有原子共平面 | |
| D. | 六氯环己烷不存在同分异构体 |
5.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能还有杂质气体( )
①CO2 ②HCl ③H2O ④O2.
①CO2 ②HCl ③H2O ④O2.
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ①④ |
9.下列不属于基本反应类型的是( )
| A. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+2CO2 | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O | D. | 2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑ |