题目内容
12.H2和O2混合气体的质量为10g,在标准状况下其体积为28L,则混合气体的总物质的量是1.25mol,O2的质量是8g,该混合气体的平均相对分子质量是8,该混合气体的密度是同条件下氧气密度的0.25倍.分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,根据总质量、总物质的量列方程计算氢气与氧气物质的量,再根据m=nM计算氧气质量,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算混合气体平均相对分子质量,相同条件下气体的密度之比等于摩尔质量之比.
解答 解:混合气体总物质的量为$\frac{28L}{22.4L/mol}$=1.25mol,
设氢气物质的量为xmol,氧气物质的量为ymol,则:
$\left\{\begin{array}{l}{x+y=1.25}\\{2x+32y=10}\end{array}\right.$
解得x=1、y=0.25
故氧气的质量为0.25mol×32g/mol=8g,
混合气体的平均摩尔质量为$\frac{10g}{1.25g}$=8g/mol,故混合气体平均相对分子质量为8,
相同条件下气体的密度之比等于摩尔质量之比,则该混合气体的密度是同条件下氧气密度的$\frac{8g/mol}{32g/mol}$=0.25倍,
故答案为:1.25;8;8;0.25.
点评 本题考查物质的量的有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列各组溶液,不用其他试剂就可以将它们区别开的是( )
| A. | HCl、K2CO3、KOH、K2SO4 | B. | NaNO3、HCl、NH4Cl、KOH | ||
| C. | BaCl2、CaCl2、Na2SO4、KNO3 | D. | K2CO3、KOH、MgSO4、KHSO4 |
17.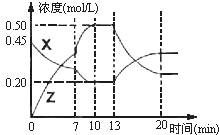 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A. | 化学方程式中a:b=1:3 | |
| B. | 推测在第7min时曲线变化的原因可能是升温 | |
| C. | 推测在第13min时该反应刚好达到化学平衡 | |
| D. | 用X表示O~10min内该反应的平均速率为v(X)=0.045mol•L-1•mol-1 |
1.下列叙述正确的是( )
| A. | 1mol任何物质中都含有NA个分子 | B. | 摩尔是物质的量的单位 | ||
| C. | 摩尔是一个基本物理量 | D. | 摩尔是表示物质数量的单位 |
2.用一定体积的8mol•L-1的盐酸配制200mL 0.2mol•L HCl溶液,需要量取8mol•L-1盐酸的体积是( )
| A. | 5mL | B. | 10mL | C. | 15mL | D. | 20mL |