题目内容
【题目】NOx的排放主要来自于汽车尾气,包含 NO2 和 NO I.
(1)用 CH4 催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:______________。
②有利于提高 NOx 的平衡转化率的反应条件是:______________(至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) H2=______________kJ/mol
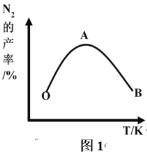
(2)为了提高 CH4 和 NO 转化为 N2 的产率,种学家寻找了一种新型的催化剂。将 CH4 和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2 的产率与温度的关系如图1所示,OA 段 N2 产率增大的原因是______________。 AB 段 N2 产率降低的可能原因是______________(填标号)
A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多
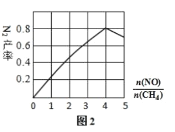
(3)N2 的产率与![]() ,由图可知
,由图可知![]() 最佳约为____________
最佳约为____________
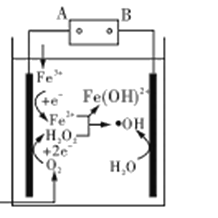
II.有人利用反应 2C(s)+2NO2(g) ![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
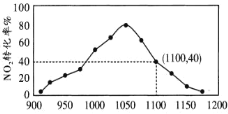
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp=______________ (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。
【答案】这两个反应均为放热很大的反应 增大 CH4 浓度或降低温度 -867 OA 段随着温度的升高,催化剂的活性增强,化学反应速率加快,因此氮气的产率逐 渐增大 AC 4 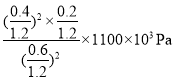 或
或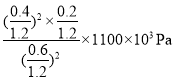
【解析】
根据热力学原理及盖斯定律分析解答;根据催化剂对反应速率的影响及平衡移动原理分析解答;根据平衡常数表达式分析解答。
(1)①熵增和焓减的反应倾向于自发,所以这两个反应在热力学上趋势均很大,其原因是这两个反应均为放热很大的反应,故答案为:这两个反应均为放热很大的反应;
②增大反应物浓度或降低温度,使平衡正向移动,有利于提高 NOx 的平衡转化率,故答案为:增大 CH4 浓度或降低温度;
③已知,a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) H1=-574kJ/mol b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) H2= -1160kJ/mol,根据盖斯定律知,![]() 得CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g),则H2=
得CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g),则H2=![]() ,故答案为:-867;
,故答案为:-867;
(2)因为反应物是按一定比例、一定流速通过装有上述新型催化剂的反应器中的,所以产率升高是因为反应速率增大,根据图示分析,OA段随着温度升高,催化剂活性增强,反应速率加快;AB段可能原因为催化剂活性降低,或是副反应增多,反应为放热反应,温度升高时平衡逆向移动,平衡常数减小,故B错误;故答案为:OA 段随着温度的升高,催化剂的活性增强,化学反应速率加快,因此氮气的产率逐渐增大;AC;
(3)由图可知![]() 约为4,产率最高,故答案为:4;
约为4,产率最高,故答案为:4;
II.压强越大反应越快,则图中(1100,40)点已经达到平衡状态,设起始时加入NO2的物质的量为1mol,则
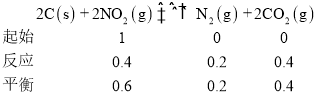
根据平衡常数表达式分析得K=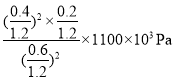 ,故答案为:
,故答案为: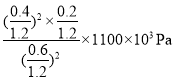 或
或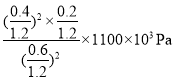 。
。