题目内容
17.富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.其制备的离子方程式为: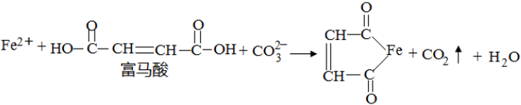
(1)Fe2+的核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6.
(2)富马酸所含元素的电负性由大到小顺序为O>C>H,C原子以sp2杂化轨道与O原子形成σ键.
(3)富马酸是无色晶体,在165℃(17毫米汞柱)升华,易溶于有机溶剂,其晶体类型为分子晶体.
(4)检验Fe2+是否氧化变质,最常用的试剂是KSCN,若溶液中有Fe3+,加入KSCN后溶液看到现象是溶液呈血红色,有人认为KSCN对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸中H-N键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸.
(5)FeO在常温条件下是良好的绝缘体,FeO在高温高压下会金属化,可以作为制富马酸亚铁的原料,FeO晶体的结构如图所示,其晶胞边长为apm,列式表示FeO晶体的密度为$\frac{288×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3(不必计算出结果,阿伏加德罗常数的值为NA).人工制备的FeO晶体中常存在缺陷(如图):

一个Fe2+空缺,另有两个Fe2+被两个Fe3+所取代,其结果晶体仍呈电中性,但化合物中Fe和O的比值却发生了变化.已知某氧化铁样品组成Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为1:11.
分析 (1)Fe是26号元素,Fe原子失去最外层2个电子生成亚铁离子,根据构造原理书写二价铁离子核外电子排布式;
(2)富马酸中含有C、H、O元素,元素的非金属性越强,其电负性越大;碳氧双键的C原子含有3个σ键1个π键,根据价层电子对互斥理论确定杂化方式;
(3)分子晶体的熔沸点较低;
(4)铁离子和KSCN溶液混合生成络合物硫氰化铁而使溶液呈血红色,该现象能检验铁离子;
含有氢键的物质熔沸点较高;
(5)该晶胞中亚铁离子个数=1+12×$\frac{1}{4}$=4,氧离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞体积=(a×10-10cm)3,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;根据电荷守恒计算Ni3+与Ni2+的离子个数之比.
解答 解:(1)Fe是26号元素,Fe原子失去最外层2个电子生成亚铁离子,根据构造原理书写二价铁离子核外电子排布式为:[Ar]3d6或1s22s22p63s23p63d6,
故答案为:[Ar]3d6或1s22s22p63s23p63d6;
(2)富马酸中含有C、H、O元素,元素的非金属性越强,其电负性越大,所以电负性O>C>H;碳氧双键的C原子含有3个σ键1个π键,根据价层电子对互斥理论确定C原子杂化方式为sp2杂化,故答案为:O>C>H;sp2杂化;
(3)分子晶体熔沸点较低,该物质熔沸点较低,则为分子晶体,故答案为:分子晶体;
(4)铁离子和KSCN溶液混合生成络合物硫氰化铁而使溶液呈血红色,该现象能检验铁离子;
异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸,
故答案为:溶液呈血红色;异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸;
(5)该晶胞中亚铁离子个数=1+12×$\frac{1}{4}$=4,氧离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞体积=(a×10-10cm)3,
密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{72}{{N}_{A}}×4}{(a×1{0}^{-10})^{3}}$g/cm3=$\frac{288×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3;设1mol Fe0.96O中含Fe3+xmol,Fe2+为(0.96-x)mol,根据晶体仍呈电中性,可知 3x+2×(0.96-x)=2×1,x=0.08mol Fe2+为(0.96-x)mol=0.88mol,即离子数之比为Fe3+:Fe2+=0.08:0.88=1:11,
故答案为:$\frac{288×1{0}^{30}}{{a}^{3}{N}_{A}}$;1:11.
点评 本题考查物质结构和性质,涉及晶胞计算、氢键、晶体类型判断、电负性、原子核外电子排布等知识点,为高频考点,只有O、N、F元素能形成氢键,难点是晶胞计算,题目难度不大.

| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ |
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | H2 分子中的σ键是s-s σ键,HClO分子中的σ键是p-p σ键 | |
| D. | C2H4分子中有5个σ键和一个π键,N2H4中只有5个σ键 |
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
| A. | 铝锂合金是铝与锂形成的一种化合物 | |
| B. | 锂是碱金属元素,性质活泼,铝锂合金与水反应生成氢气 | |
| C. | 铝离子和锂离子的核外电子排布相同 | |
| D. | 若铝锂合金中锂含量为1.1%,则127.3g铝锂合金中含有锂原子0.2mol |
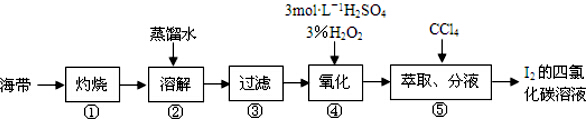
| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |


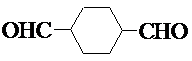 .
. .
. .
. .
.