题目内容
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。回答下列问题:
(1)CO2与H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
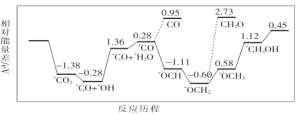
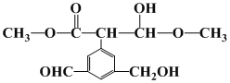
容易得到的副产物有CO和CH2O,其中相对较多的副产物为__;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中__(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
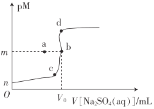
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
压强p1__(填“<”或“>”)p2。
②在p1、100℃条件下,b点时v正__(填“<"或“>”)v逆。
③已知:反应速率v=v正-v逆=k正![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的![]() =__(保留3位有效数字)。
=__(保留3位有效数字)。
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。
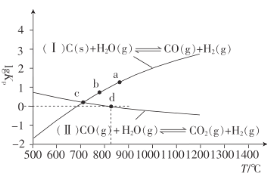
反应(Ⅱ)的△H__(填“大于”“等于”或“小于”)0。
②c点时,反应C(s)+CO2(g)![]() 2CO(g)的KP=__(填数值)。
2CO(g)的KP=__(填数值)。
③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为__;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),重新达到平衡时,CO的平衡转化率__(填“增大”“减小”或“不变”)。
【答案】CO A < > 2.85 小于 1 80% 不变
【解析】
(1)由图可知,副产物有CO和CH2O,反应的能垒越低,反应越容易进行,副产物的量越多;反应的能垒越大,反应的反应速率越慢;
(2)①该反应正向是气体体积减小的反应,气体条件相同时,压强越大,CO2的平衡转化率越高;
②由图可知,在p1、100℃条件下,b点CO2的转化率小于平衡时CO2的平衡转化率,则反应正向进行;
③平衡时υ正=υ逆,即k正x(CO2)x(H2)3=k逆x(CH3OH)x(H2O),则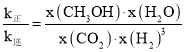 =K,b点CO2的转化率为0.4,根据三段式计算各物质的物质的量分数,根据反应速率公式计算b处
=K,b点CO2的转化率为0.4,根据三段式计算各物质的物质的量分数,根据反应速率公式计算b处![]() 的值;
的值;
(3)①反应(Ⅱ)随温度升高lgKP减小,即升高温度,平衡逆向移动;
②根据盖斯定律反应Ⅰ减去反应Ⅱ得到C(s)+CO2(g)![]() 2CO(g),所以C(s)+CO2(g)
2CO(g),所以C(s)+CO2(g)![]() 2CO(g)的平衡常数KP等于反应Ⅰ的平衡常数除以反应Ⅱ的平衡常数;
2CO(g)的平衡常数KP等于反应Ⅰ的平衡常数除以反应Ⅱ的平衡常数;
③反应(II)

结合平衡常数减小计算;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),相当加压,根据平衡移动方向判断。
(1) 由图可知生成副产物CH2O的能量变化大,即能垒高,反应难进行,生成的量少,生成副产物CO的能量变化小,即能垒低,反应容易进行,生成的量多,所以相对较多的副产物为CO;由图可知生成甲醇的过程中,能垒最高(为1.64eV)的变化为*CO+*OH→*CO+*H2O,该反应速率最慢,决定整个反应的快慢,所以要想提高整个反应速率,应该降低该反应的能垒,故答案为A;
(2)①因为该反应的气体分子总数减少,则气体条件相同时,压强越大,二氧化碳的转化率越大,相同温度下,p2时CO2的转化率比p1时的大,所以压强p1<p2;
②在p1、100℃条件下,a点为平衡点,与a点相比,b点的二氧化碳转化率较低,则b点正反应速率大于逆反应速率,即υ正>υ逆;
③a点反应三段式:
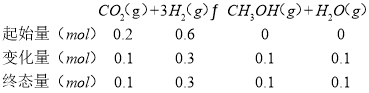
x(CO2)=x(CH3OH)=x(H2O)=![]() ,x(H2)=
,x(H2)=![]() ,此时,
,此时,![]() ,故
,故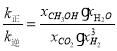 =
=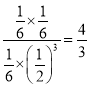 ;
;
b点各成分的量也可由三段式计算:

故![]() ,此时,
,此时,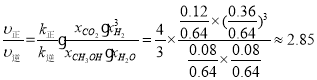 ;
;
(3)①反应(Ⅱ)的lgKP随温度升高而减小,即升高温度,平衡逆向移动,则△H<0;
②根据盖斯定律反应Ⅰ减去反应Ⅱ得到C(s)+CO2(g)![]() 2CO(g),所以C(s)+CO2(g)
2CO(g),所以C(s)+CO2(g)![]() 2CO(g)的平衡常数KP等于反应Ⅰ的平衡常数除以反应Ⅱ的平衡常数,由于c点两者的lgKP相等,则反应C(s)+CO2(g)
2CO(g)的平衡常数KP等于反应Ⅰ的平衡常数除以反应Ⅱ的平衡常数,由于c点两者的lgKP相等,则反应C(s)+CO2(g)![]() 2CO(g)的lgKP=0,即c点时,反应C(s)+CO2(g)2CO(g)的KP=1;
2CO(g)的lgKP=0,即c点时,反应C(s)+CO2(g)2CO(g)的KP=1;
③d点时,反应(Ⅱ)的KP=1;

反应是气体体积不变化的反应,可将各物质的物质的量数值直接代入计算,即![]() ,解得x=0.4,CO的转化率为
,解得x=0.4,CO的转化率为![]() ×100%=80%,该反应前后气体的分子数不变,达到平衡时,向容器中再充入0.5molCO、2molH2O(g)相当增大压强,平衡不发生移动,所以CO的平衡转化率不变。
×100%=80%,该反应前后气体的分子数不变,达到平衡时,向容器中再充入0.5molCO、2molH2O(g)相当增大压强,平衡不发生移动,所以CO的平衡转化率不变。

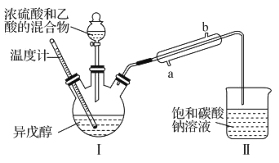
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯