题目内容
【题目】卤族元素是典型的非金属元素,包括F,Cl,Br,I等.请回答下面有关问题:
(1)同主族元素的电负性大小存在一定的规律,卤族元素F,Cl,Br,I的电负性由小到大 的顺序是_______;
(2)Br原子的核外电子排布式为_______;
(3)用价层电子对互斥理论判断BeCl2的构型为_______,BF3分子中B﹣F键的键角为_______;
(4)CCl4分子中碳原子的杂化方式为_______,NF3分子的空间构型为_______;
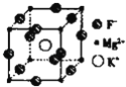
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为_______。
【答案】I<Br<Cl<F [Ar]3d104s24p5 直线型 120° sp3 三角锥形 20%
【解析】
(1)根据电负性的变化规律解答;
(2)溴原子序数为35,结合核外电子的排布规律书写;
(3)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb)计算判断;
(a-xb)计算判断;
(4)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb)计算判断;
(a-xb)计算判断;
(5)利用均摊法确定晶胞的化学式,再计算质量分数。
(1)同主族自上而下,电负性减弱,故电负性I<Br<Cl<F,故答案为:I<Br<Cl<F;
(2)Br原子的核外电子排布式为:[Ar]3d104s24p5(或1s22s22p63s23p63d104s24p5),故答案为:[Ar]3d104s24p5(或1s22s22p63s23p63d104s24p5);
(3)BeCl2中Be原子上含有2个σ 键,孤电子对数=![]() (a-xb)=
(a-xb)=![]() (2-2×1)=0,Be原子采用sp杂化,是直线型结构,两个Be-Cl键间的夹角为180°;BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
(2-2×1)=0,Be原子采用sp杂化,是直线型结构,两个Be-Cl键间的夹角为180°;BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=![]() (a-xb)=
(a-xb)=![]() (3-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,故答案为:直线型;120°;
(3-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,故答案为:直线型;120°;
(4)CCl4中C和氯原子均形成四个单键,中心原子上的孤电子对数=![]() (a-xb)=
(a-xb)=![]() (4-4×1)=0,采用sp3杂化;NF3中N原子上含有3个σ 键,孤电子对数=
(4-4×1)=0,采用sp3杂化;NF3中N原子上含有3个σ 键,孤电子对数=![]() (a-xb)=
(a-xb)=![]() (5-3×1)=1,N原子采用sp3杂化,是三角锥型结构,故答案为:sp3;三角锥形;
(5-3×1)=1,N原子采用sp3杂化,是三角锥型结构,故答案为:sp3;三角锥形;
(5)该晶胞中含有镁原子个数=8×![]() =1,钾原子个数=1,氟原子个数=12×
=1,钾原子个数=1,氟原子个数=12×![]() =3,所以其化学式为KMgF3,该化合物中镁元素的质量分数=
=3,所以其化学式为KMgF3,该化合物中镁元素的质量分数=![]() ×100%=20%,故答案为:20%。
×100%=20%,故答案为:20%。