题目内容
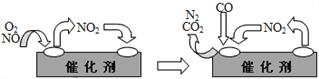
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
【答案】(1)EB-EC 降低活化能的作用更显著
(2)细胞核或核糖体 核糖核苷酸或氨基酸
(3)A 竞争性 随底物浓度的增加,与抑制剂结合的酶的比例越小,抑制作用逐渐减弱并接近正常的最大反应速度

(4)含中有蛋白酶,把信号肽切去
(5)有氧呼吸
【解析】试题分析:
(1)分析题图可知,非酶催化的化学反应所需要的活化能为EB,而酶促反应的活化能为EC,则该酶降低的活化能为EB-EC;与一般催化剂催化的化学反应活化能相比,酶降低活化能的作用更显著。
(2)由于酶的化学本质是蛋白质或RNA,产生场所为核糖体或细胞核;蛋白质的基本单位为氨基酸,RNA的基本单位为核糖核苷酸,因此合成原料为核糖核苷酸或氨基酸。
(3)由于图乙表示加入抑制剂对起始反应速率的影响,则A曲线为没加入抑制剂的反应速率曲线,为对照组,BC为加入抑制剂后反应速率曲线;分析曲线B,随底物浓度的增加,酶促反应速率增加,说明B为竞争性抑制剂,当底物浓度较大时,与抑制剂结合的酶的比例较小,抑制作用逐渐减弱并接近正常的最大反应速率;加入酶的激活剂后,达到最大反应速率所需要的时间变短,但最大反应速率不变,可以画出曲线见答案。
(4)根据题意,信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列,说明内质网含中有蛋白酶,把信号肽切去。
(5)由于蛙的红细胞有细胞核和细胞器,ATP的主要来源是有氧呼吸。