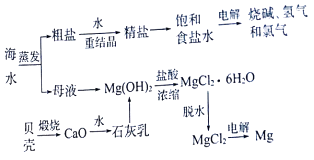
题目内容
【题目】近年我省汽车拥有量呈较快增长趋势。汽车尾气已成为主要的空气污染物;部分大城市交通干道的NOx和CO严重超过国家标准,已具有发生光化学烟雾污染的潜在危险。
(1)某研究性学习小组在一烟雾实验箱中对光化学烟雾形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化,记录于下图。根据图中数据,下列推论中,最不合理的是_____________
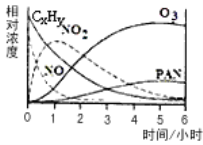
A.NO的消失的速率比CxHy快 B.NO生成NO2
C.CxHy及NO2可以生成PAN及O3 D.O3生成PAN
(2)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
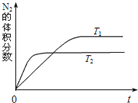
①上图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g) 2NO(g)为___________(填“吸热”或“放热”)反应。
②2000℃时,向容积为2L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时该反应的平衡常数K=____________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_______________。
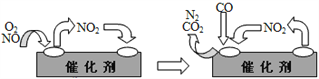
③为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。 写出上述变化中的总化学反应方程式:________________________。
(3)当采用稀薄燃烧[指汽油在较大空/燃比(空气与汽油的体积比)条件下的燃烧]发动机时,此时汽车排除尾气中的主要污染物为NOx。为减少NOx的排放,采用了吸附-还原型催化剂,用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H1=-574 kJ/mol
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g); △H2
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=____________。
【答案】 D 吸热 ![]() 或0.11 1/7或14.3% 2NO+O2+4CO
或0.11 1/7或14.3% 2NO+O2+4CO![]() 4CO2+N2 -1160kJmol-1
4CO2+N2 -1160kJmol-1
【解析】(1)A、由曲线斜率可知在某一时间段内NO消失的速率比CxHy快,故A正确;B、NO的浓度一直在减少,NO2的浓度先增加后减少,在0-1时间段内NO可能生成NO2,故B正确;C、图中O3和PAN的浓度增加,CxHy的浓度减少,CxHy及NO2在某一时间段内可能反应生成PAN和O3,故C正确;D、O3的浓度一直在增加,不可能作为反应物,故D错误;故选D;
(2)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应,故答案为:吸热
②利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,
N2(g)+O2(g)2NO(g),
起始(mol/L):5 2.5 0
反应(mol/L):0.5 0.5 1
平衡(mol/L):4.5 2 1
所以平衡常数k=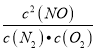 =
=![]() =
=![]() ;
;
令N2转化的物质的量为xmol,则
N2(g)+O2(g)2NO(g),
起始(mol): 1 1 0
反应(mol): x x 2x
平衡(mol):1-x 1-x 2x
所以平衡常数k=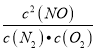 =
=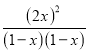 =
=![]() ;解得x=
;解得x=![]() ,N2的转化率为
,N2的转化率为![]() ×100%=14.3%,故答案为:
×100%=14.3%,故答案为: ![]() ;14.3%
;14.3%
③NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO![]() 4CO2+N2,故答案为:2NO+O2+4CO
4CO2+N2,故答案为:2NO+O2+4CO![]() 4CO2+N2;
4CO2+N2;
(3)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2,将两个方程式相加:
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-574kJmol-1+△H2
2mol -574kJmol-1+△H2
1mol 867kJmol-1
则: ![]() =
=![]() ,△H2=-1160kJmol-1,故答案为:-1160kJmol-1。
,△H2=-1160kJmol-1,故答案为:-1160kJmol-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案