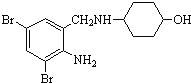
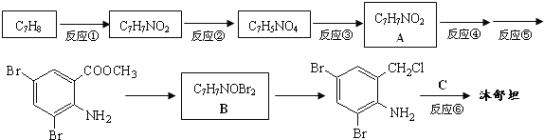
题目内容
【题目】长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量ag样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到bg固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?________;其理由是________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是_____________________。
(3)步骤⑦的“合格”标准是:_____________________。
(4)实验测得样品中无水亚硫酸钠占原有样品的质量分数是_____________________。(列出算式,不需化简)
【答案】不能 在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果错误 保证得到的沉淀都是BaSO4,没有BaSO3 连续两次称量的质量不变 (ag-142 g·mol-1×![]() )×
)×![]() ×100%
×100%
【解析】
Na2SO3容易被空气中的O2氧化为Na2SO4,但a g样品配成溶液加入HCl后,Na2SO3已经转化为SO2,再加BaCl2就只得BaSO4沉淀。通过BaSO4的质量bg求出变质生成的Na2SO4的质量即可。
(1)若加入硝酸钡,硝酸根离子在酸性条件下具有强氧化性,可把亚硫酸根离子氧化成硫酸根离子,导致硫酸钠的含量增加,亚硫酸钠纯度偏小,故答案为:不能;在酸性条件下,硝酸根离子能把亚硫酸根离子氧化成硫酸根离子,造成结果有误差;
(2)要测定亚硫酸钠的纯度,需要先测出药品中硫酸钠的质量,需要使用氯化钡将硫酸根离子转化成硫酸钡沉淀,所以加盐酸酸化除去溶液中亚硫酸根离子,故答案为:用盐酸酸化可以将SO32-转化为SO2除去,保证沉淀全部为硫酸钡;
(3)重复⑤、⑥操作直到合格,最后得到bg固体,称量至恒重,防止造成结果有误差,故答案为:连续两次称量的质量不变;
(4)硫酸钡沉淀质量为bg,硫酸钡的物质的量为:n(BaSO4)=n(Na2SO4)=![]() ,则实验测得样品中无水亚硫酸钠占原有样品的质量分数是(ag-142 g·mol-1×
,则实验测得样品中无水亚硫酸钠占原有样品的质量分数是(ag-142 g·mol-1×![]() )×
)×![]() ×100%,故答案为:(ag-142 g·mol-1×
×100%,故答案为:(ag-142 g·mol-1×![]() )×
)×![]() ×100%。
×100%。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
【题目】部分短周期元素的原子半径及主要化合价如下表:
元素 |
|
|
|
|
|
原子半径/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合价 | +2 | +1 | +2 | +6、-2 | -2 |
下列叙述正确的是( )
A.![]() 一定是金属元素
一定是金属元素
B.原子半径大小:![]()
C.![]() 的简单氢化物的沸点比
的简单氢化物的沸点比![]() 的大
的大
D.![]() 、
、![]() 可能形成阴、阳离子个数比为
可能形成阴、阳离子个数比为![]() 的两种化合物
的两种化合物