题目内容
8.下列关于晶体的说法中,不正确的是( )①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①晶体中原子呈周期性有序排列而非晶体中原子排列无序,晶体有自范性,非晶体无自范性;
②含有金属阳离子的晶体不一定是离子晶体,可能是金属晶体;
③共价键可决定分子的稳定性;
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,有自范性.
解答 解:①晶体中原子呈周期性有序排列而非晶体中原子排列无序,晶体有自范性,非晶体无自范性,可以利用X射线鉴别晶体和非晶体,故正确;
②金属晶体是由金属阳离子和自由电子构成的,所以含有金属阳离子的晶体不一定是离子晶体,可能是金属晶体,故错误;
③共价键可决定分子的稳定性,分子间作用力决定分子晶体熔沸点,故错误;
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,有自范性,可以利用X射线鉴别晶体和非晶体,故正确;
故选D.
点评 本题考查晶体和非晶体区别及晶体构成微粒判断等知识点,明确晶体和非晶体特点、晶体构成微粒及晶体稳定性影响因素即可解答,注意分子间作用力和氢键影响分子晶体熔沸点、化学键影响其稳定性,为易错点.

练习册系列答案
相关题目
18.下列做法不正确的是( )
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.1mol•L-1碳酸钠溶液 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
19.(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
16.下列各组离子在指定的条件下一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、Cl- | |
| B. | pH=7的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| C. | 使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- | |
| D. | 加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
3.如图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ下列说法合理的是( )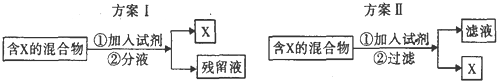

| A. | 若含X的混合物为碘水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液 | |
| B. | 若含X的混合物为乙醇和水,可通过方案Ⅱ进行分离,加入试剂为生石灰 | |
| C. | 若含X的混和物为KNO3和NaCl,可通过方案II进行分离,加入试剂为适量沸水 | |
| D. | 若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油 |
13.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
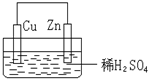

| A. | 铜片为负极 | B. | 锌片为负极 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片上没有有H2逸出 |
20.1mol某有机物在稀硫酸作用下,水解生成2mol相同的物质.下列物质中:①蔗糖 ②麦芽糖 ③淀粉④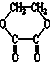 ⑤
⑤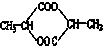 ⑥
⑥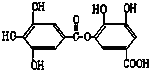 ⑦
⑦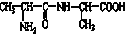 ,符合题意的物质可能是( )
,符合题意的物质可能是( )
 ⑤
⑤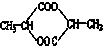 ⑥
⑥ ⑦
⑦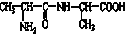 ,符合题意的物质可能是( )
,符合题意的物质可能是( )| A. | ①②⑤⑦ | B. | ②④⑤⑦ | C. | ②⑤⑥⑦ | D. | ①④⑤⑥ |
17.某同学根据原电池的构成及其原理,设计了以下几个装置,以证明铁、铜金属性强弱顺序.你认为下列现象符合客观事实的是( )
| A. | 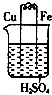 铁上有气泡 铁上有气泡 | |
| B. |  铜上有气泡 铜上有气泡 | |
| C. |  铁片上析出红色的铜 铁片上析出红色的铜 | |
| D. |  AB为导体,反应一段时间后,铁球向下倾斜 AB为导体,反应一段时间后,铁球向下倾斜 |
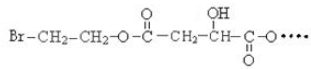
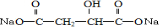 BHOCH2CH2OHC
BHOCH2CH2OHC D
D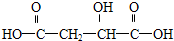
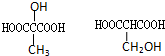
 .
.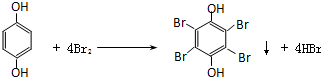 .
.