题目内容
1.下列不能表明醋酸是弱电解质的是( )| A. | 0.1mol/L的醋酸水溶液的pH值为3 | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使石蕊变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A、0.1mol/L的醋酸水溶液的pH值为3,说明醋酸存在电离平衡,为弱电解质,故A不选;
B、盐酸是强电解质,相同浓度的醋酸水溶液的导电性比盐酸弱,说明醋酸存在电离平衡,为弱电解质,故B不选;
C、醋酸水溶液能使石蕊变红,只能说明醋酸的水溶液显酸性,不能证明其为弱电解质,故C选;
D、醋酸稀溶液中同时存在CH3COOH和CH3COO-,说明醋酸存在电离平衡,为弱电解质,故D不选;
故选C.
点评 本题考查了弱电解质的判断,题目难度不大,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
11.用稀硫酸、氢氧化钠和铝为原料制取氢氧化铝,甲、乙、丙三学生分别用三种不同途径制备.
甲.Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙.Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙.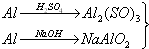 →Al(OH)3
→Al(OH)3
若要制备等量的氢氧化铝,则( )
甲.Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙.Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙.
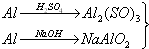 →Al(OH)3
→Al(OH)3若要制备等量的氢氧化铝,则( )
| A. | 乙消耗原料少 | B. | 三者消耗原料相同 | ||
| C. | 丙消耗原料最少 | D. | 甲、乙消耗原料相同 |
9.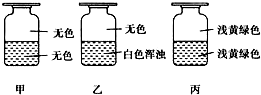 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水.
 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )①AgNO3溶液 ②NaOH溶液 ③水.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
16.淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征.现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中的液体进行下列实验,能证明半透膜完好无损的是( )
| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |
13.已知0.1mol/L的醋酸溶液存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
10.下面有关铜的化合物的性质叙述中正确的是( )
| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
11.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
【探究目的】分析黑色粉末X的组成,并进行相关实验.
【查阅资料】①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+═2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)═9Fe(NO3)3+NO↑+14H2O
【实验探究】Ⅰ.定性检验
(1)实验③发生的反应的离子方程式为Fe+Cu2+=Fe2++Cu.
(2)上述实验说明黑色粉末X中含有Fe和Fe3O4.
Ⅱ.定量测定
根据下图所示的实验方案进行实验并记录数据:
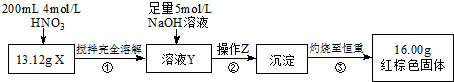
(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe 0.11mol Fe3O4 0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
【探究目的】分析黑色粉末X的组成,并进行相关实验.
【查阅资料】①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+═2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)═9Fe(NO3)3+NO↑+14H2O
【实验探究】Ⅰ.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(2)上述实验说明黑色粉末X中含有Fe和Fe3O4.
Ⅱ.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe 0.11mol Fe3O4 0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
 ,ZO3-的空间构型是平面三角形;
,ZO3-的空间构型是平面三角形;