题目内容
科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。下列说法中不正确的是
| A.维生素C具有还原性 |
| B.上述过程中砷元素发生还原反应 |
| C.上述过程中+5价砷类物质作氧化剂 |
| D.1 mol+5价砷完全转化为+3价砷,共失去2 mol电子 |
解析试题分析:本题考查氧化还原反应,明确氧化剂、还原剂中元素的化合价变化是解答本题的关键。根据题意知,对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物,则砷元素的化合价降低,+5价砷类化合物为氧化剂,维生素C中某元素的化合价升高,则维生素C为还原剂。A、维生素C中某元素的化合价升高,维生素C为还原剂,具有还原性,正确;B、砷元素的化合价由+5价降低到—3价,发生还原反应,正确;C、砷元素的化合价由+5价降低到—3价,+5价砷类化合物为氧化剂,正确;D、1 mol+5价砷完全转化为+3价砷,共得到2 mol电子,错误。
考点:考查氧化还原反应。

练习册系列答案
相关题目
下列说法正确的是
| A.氧化还原反应中一定有某些元素的化合价发生变化 |
| B.金属离子被还原一定得到金属单质 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 |
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
在汽车尾气处理装置中常发生如下反应:4CO+2NO2=4CO2+N2。下列对该反应的说法中正确的是
| A.该反应属于置换反应 |
| B.该反应中氧化剂是CO,还原剂是NO2 |
| C.该反应生成14 g N2时,转移8 mol e- |
| D.该反应能减少汽车尾气对环境的污染 |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7 |
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO△ 3Cu+N2+3H2O,对此反应的分析合理的是
| A.该反应属置换反应 |
| B.NH3被氧化为N2 |
| C.反应体现了金属铜的还原性 |
| D.每生成1mol H2O 就伴随着1mol电子转移 |
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
有如下变化:A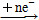 An- ΔH1<0,B
An- ΔH1<0,B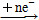 Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
| A.氧化性:A<B | B.还原性:An-<Bn- |
| C.稳定性:B<A | D.稳定性:An-<Bn- |
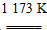 aTiCl4+cCO
aTiCl4+cCO Ti+2MgCl2
Ti+2MgCl2