题目内容
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为 mol.
| A.2.50 | B.4.00 | C.7.50 | D.3.15 |
D
解析试题分析:若混合物全是CuS,其物质的量为120g/80g/mol=1.5mol,转移电子数为1.5×(6+2)=12mol。NO 的物质的量为amol,HNO3→NO,由得失电子守恒3a=12,计算得a=4mol;若混合物全是Cu2S,其物质的量为0. 75mol,转移电子数0. 75×10=7.5mol,由得失电子守恒3a=7.5计算得a=2.5,所以a可能为3.15mol。
考点:铜及其化合物。

一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO△ 3Cu+N2+3H2O,对此反应的分析合理的是
| A.该反应属置换反应 |
| B.NH3被氧化为N2 |
| C.反应体现了金属铜的还原性 |
| D.每生成1mol H2O 就伴随着1mol电子转移 |
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O则该反应中化合价发生变化和未发生变化的N原子数之比为
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫 |
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.铈的四种核素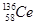 、 、 、 、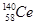 、 、 ,它们互称为同素异形体 ,它们互称为同素异形体 |
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O
下列说法中不正确的是
| A.每生成1mol Fe(FeO2)2转移4mol电子 | B.该反应中Fe2+和S2O32-都是还原剂 |
| C.3mol Fe2+被氧化时有1molO2被还原 | D.反应方程式中化学计量数x=4 |
将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3= 9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只表现氧化性 |
| C.磁性氧化铁中的所有铁元素全部被氧化 |
| D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |