题目内容
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知:
②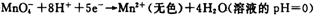
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为 (填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):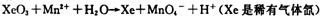
已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是 。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式 。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
(14分,每空2分)(1)MnO2 (2)无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)
(3)2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O
(4)Mn2+-2e-+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O 2mol 87
解析试题分析:(1)根据反应①②可知,在碱性溶液中MnO4-被还原生成物是MnO42-,在酸性溶液中MnO4-被还原生成物是Mn2+,即溶液的酸性越强,还原产物中Mn的化合价越低,所以在中性溶液中,MnO4-被还原生成物是MnO2。
(2)根据已知反应可知,XeO3能把Mn2+氧化生成MnO4-。又因为氯离子的还原性强于Mn2+的还原性,所以反应中还有氯气生成,因此可能观察到的现象是无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)。
(3)草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去,这说明草酸具有还原性,能被酸性高锰酸钾溶液氧化生成CO2,所以反应的离子方程式是2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O。
(4)电解池中阳极失去电子,发生氧化反应,则Mn2+在阳极失去电子,发生氧化反应,因此阳极电极反应式是Mn2+-2e-+2H2O=MnO2+4H+。铅蓄电池中负极是Pb,正极是PbO2,所以铅蓄电池的总反应方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。所以根据方程式可知,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为2mol。根据电子得失守恒可知,阳极生成1mol MnO2,质量是87g。
考点:考查氧化还原反应的判断、方程式的书写、实验现象分析、以及电化学原理的应用和有关计算

Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(2)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。

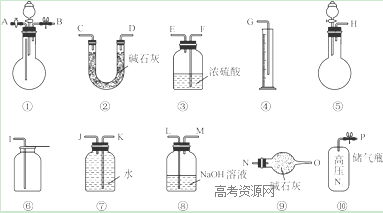
Ⅱ.过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序:
甲同学:⑤—⑧—③—⑦—④; 乙同学:⑤—③—②。
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。
(2)乙同学想通过实验测得的数据是________________。有人认为按他测得的数据计算出的实验结果可能偏高,原因是________________; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
| | |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
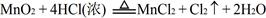 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。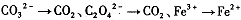 ,找出其中一个变化与“
,找出其中一个变化与“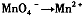 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。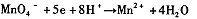
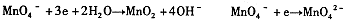 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。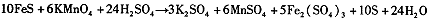
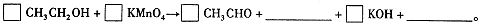
 AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
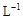 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)