题目内容
9.肼是火箭发射常用动力材料,某研究性学习小组据化工生产水合肼的原理,用尿素和NaClO的碱性溶液在实验室制备水合肼:(NH2)2CO+NaOH+NaClO═Na2CO3+N3H4•H2O+NaCl有关水合肼信息如下:无色液体,熔点小于-40℃,沸点:118℃(101kPa)与水、乙醇互溶;有强还原性、强碱性和强腐蚀性,能腐蚀橡胶、皮革、软木、玻璃等.
制备步骤:
步骤1:制备Cl2,用制得的Cl2制NaClO;
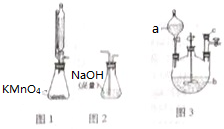
(1)用图1在常温下,制取Cl2,写出生成Cl2的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)将制得的Cl2,直接通入图2制备NaClO;请写出此操作有哪些不足之处?没有除去氯气中混有的HCl,影响产品中NaClO含量;提出你的建议:加一个用盛有饱和氯化钠溶液的洗气瓶;
步骤2:将制得的NaClO碱性溶液,于图3装置中进行反应制取N2H4•H2O;
(3)a中应装:NaClO碱性溶液;b中应装尿素;(填试剂成份)
反应过程中NaClO不能过量的理由:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;(用相关反应方程式表示)
(4)反应容器b应选用C(填序号)
A.普通玻璃B.石英玻璃C.铁质容器D.陶瓷容器
步骤3:
(5)得到的反应混合物应采用蒸馏方法进行分离;有同学提议直接用图3装置进行操作,要达到目的还需补充的仪器有:牛角管、锥形瓶、酒精灯、冷凝管和温度计.
分析 (1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气与水;
(2)氯气中混有挥发出的HCl,会影响产品中NaClO含量,用盛有饱和氯化钠溶液的洗气瓶除去HCl;
(3)水合肼有强还原性,NaClO具有强氧化性,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;NaClO过量会氧化水合肼生成氮气、氯化钠水;
(4)由题目信息,水合肼能腐蚀橡胶玻璃等,玻璃塞属于硅酸盐,也可以腐蚀陶瓷,应选择铁质容器;
(5)水合肼为液态,与水互溶,沸点相差较大,应擦去分馏方法进行分离;需要用冷凝水冷凝蒸出的馏分,需要温度计控制收集118℃的馏分.
解答 解:(1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气与水,反应离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)氯气中混有挥发出的HCl,与氢氧化钠反应生成NaCl,会影响产品中NaClO含量,添加一个用盛有饱和氯化钠溶液的洗气瓶除去HCl,
故答案为:没有除去氯气中混有的HCl,影响产品中NaClO含量;加一个用盛有饱和氯化钠溶液的洗气瓶;
(3)水合肼有强还原性,NaClO具有强氧化性,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化,故分液漏斗中的溶液是NaClO碱性溶液,b中应装尿素;
NaClO过量会氧化水合肼生成氮气、氯化钠水,反应方程式为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,
故答案为:NaClO碱性溶液;尿素;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(4)由题目信息,水合肼能腐蚀橡胶玻璃等,玻璃塞属于硅酸盐,也可以腐蚀陶瓷,应选择铁质容器,
故选:C;
(5)水合肼为液态,与水互溶,沸点相差较大,应擦去分馏方法进行分离;需要用冷凝水冷凝蒸出的馏分,需要温度计控制收集118℃的馏分,
故答案为:蒸馏;冷凝管、温度计.
点评 本题考查物质制备实验,涉及氯气制备、对装置与操作的分析评价、物质分离提纯等,关键是对题目信息的理解应用,题目难度中等.

I.【查阅资料】
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
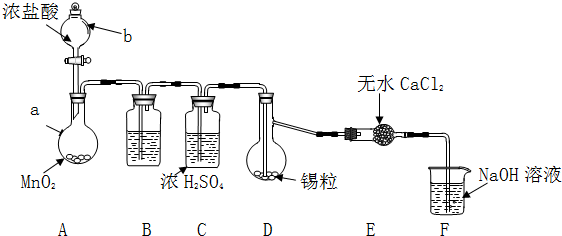
实验装置如图所示(省略夹持和加热装置)
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是分液漏斗,其中无水CaCl2的作用是吸收水蒸气,防止进入D中使SnCl4水解,B中的试剂是C(选填下列字母编号).
A.Na2CO3 溶液 B.NaOH溶液 C.饱和NaCl溶液 D.NaHCO3溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置充满黄绿色气体后(填实验现象),再加热熔化锡粒,反应完后,停止加热.
(3)待反应结束后,经过滤(填写操作名称)、洗涤、干燥,可回收利用装置A中未反应完的MnO2.
Ⅲ.[探究与反思]
(1)装置F中吸收Cl2发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充连有冷凝管的集气瓶(填装置名称).
(3)为验证产品中是否含有SnCl2,该小组设计了以下实验方案:(所需试剂从稀HNO3、稀HCl、FeCl3溶液、FeCl2溶液、KSCN溶液、蒸馏水中选择)
取适量0.5mL产品溶入20mL蒸馏水中,加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,若不出现红色(填实验现象),则含有SnCl2,否则无SnCl2.
| A. | 放出1780kJ的能量 | B. | 放出1220kJ的能量 | ||
| C. | 放出450kJ的能量 | D. | 吸收430kJ的能量 |
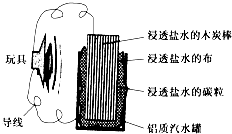 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
| A. | 灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 | |
| B. | 灯丝附近温度越高,WI2(g)的转化率越低 | |
| C. | 该反应的平衡常数表达式是K=$\frac{c(W)•c({I}_{2})}{c(W{I}_{2})}$ | |
| D. | 灯内温度升高时,压强不会变 |