题目内容
17.混合物的分离和提纯是化学实验一项基本操作.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Ca(OH)2]=5.5×10-6.
在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;如果制取的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有饱和MgCl2溶液的烧杯中.
分析 难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀.
解答 解:难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀;
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;饱和MgCl2溶液.
点评 本题考查Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
7.下列叙述正确的是( )
| A. | 所有的非金属元素都分布在p区 | |
| B. | 在CaO和SiO2晶体中都不存在单个小分子 | |
| C. | 单质中一定含有非极性键 | |
| D. | C2H6是碳链为直线型的非极性分子,可推测C3H4也是碳链为直线型的非极性分子 |
5.下列物质不能和水反应的是( )
| A. | NH3 | B. | Cu | C. | CaO | D. | SiO2 |
6.陶瓷不具有以下的性质( )
| A. | 可导电 | B. | 耐酸碱 | C. | 抗氧化 | D. | 耐高温 |
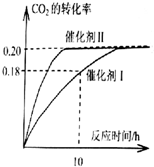 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1 ,过氧化氢
,过氧化氢
 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.