题目内容
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。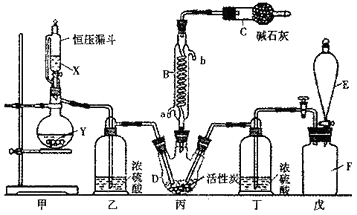
(1)仪器E的名称是 , 由B的使用可知SO2与氯气之间的反应属于(填“放”或“吸”)热反应,B处反应管冷却水应从 (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是。
(2)试剂X、Y的组合最好是。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是 .
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为 %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是。
【答案】
(1)分液漏斗;放;a;该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成
(2)c
(3)饱和食盐水;SO2+ Cl2+2H2O=H2SO4+2HCl;
(4)86.9
(5)因为SO2Cl2自身分解生成Cl2 , Cl2溶于使液体呈黄色;
【解析】(1)根据装置图可知,E为分液漏斗,因蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应;根据下进上出,的原则,B处反应管冷却水应从a接口通入;由于该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成;故答案为:分液漏斗;放;a;该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成;
(2)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2 , 所以用c.60% H2SO4+K2SO3来制备SO2 , 故选c;
(3)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,氯气在水存在的条件下可将SO2氧化成硫酸,自身被还原为HCl,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:饱和食盐水;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)设所得馏分中二氯化砜的质量百分含量为x,则:
SO2Cl2~H2SO4~ | BaSO4 |
135 | 233 |
1.00g×x | 1.5g |
所以135:233=1.00g×x:1.5g
解得x=86.9%
故答案为:86.9;
(5)SO2Cl2久置后分解会生成氯气,可能是溶解氯气所致,故答案为:二氯化砜久置后分解生成的氯气,溶解在二氯化砜中,使液体呈黄色。
故答案为:(1)分液漏斗;放;a;该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成;(2)c;(3)饱和食盐水;SO2+ Cl2+2H2O=H2SO4+2HCl;(4)86.9;(5)因为SO2Cl2自身分解生成Cl2 , Cl2溶于使液体呈黄色;
(1)结合常用仪器的使用方法;第四问结合平衡移动分析即可;
(2)制取二氧化硫,可采用强酸制取弱酸原理进行;
(3)氯气不溶于饱和食盐水;氯气具有氧化性、二氧化硫具有还原性,二者可发生氧化还原反应;
(4)找出反应关系式![]() 进行计算即可;
进行计算即可;
(5)二氯化砜不稳定,易分解,结合氯气为黄绿色气体,可知分解产生氯气;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在容积为2L的3个密闭容器中发生反应3A(g)+B(g)xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1 , 可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 molL﹣1min﹣1