题目内容
【题目】N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值。请回答下列问题:
(1)N元素与Al、Si等元素在一定条件下生成AlN和Si3N4 , 实验测得二者在真空条件下的稳定存在的最高温度2200℃和1900℃,硬度类似金刚石,常用作耐高温和耐磨材料。请推测它们属于晶体类型。
(2)PCl3和PCl5是磷元素形成的两种重要化合物,请根据价电子互斥理论推测PCl3的空间构型。
(3)As的核外电子排布式中不同类型(s、p、d、f等)的电子比是 。
(4)Cr元素价电子排布式为。
(5)砷化镓以第三代半导体著称,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中已知砷化镓的晶胞结构如右图所示,则砷化镓晶胞结构与NaCl晶胞(填“相同”或“不同”)。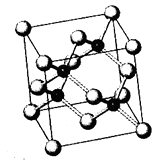
(6)根据As和Ga在元素周期表中的位置判断,第一电离能AsGa(填“<”“>”或“=”)。
(7)(CH3)3Ga中镓原子的杂化类型为。
【答案】
(1)原子
(2)三角锥形
(3)s电子:p电子:d电子=8:15:10
(4)3d54s1
(5)不同
(6)>
(7)sp2杂化;
【解析】(1)根据AlN和Si3N4 , 稳定存在的最高温度2200℃和1900℃,硬度类似金刚石,常用作耐高温和耐磨材料等性质推测它们属于原子晶体;
(2)PCl3 中P原子价层电子对个数是3且含有一个孤电子对,P采取sp3杂化,空间构型为三角锥形;
(3)As为33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3 , 不同类型的电子比为s电子:p电子:d电子=8:15:10;
(4)Cr是24号元素,价电子排布式为3d54s1;
(5)GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同;
(6)同周期元素从左到右第一电离呈增大趋势,但第VA族大于第IIIA族,第IIA族大于第IIIA族,所以则第一电离能:As>Ga;
(7)(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化;
所以答案是:(1)原子;(2)三角锥形;(3)s电子:p电子:d电子=8:15:10;(4)3d54s1;(5)不同;(6)>;(7)sp2杂化;
【考点精析】利用原子晶体对题目进行判断即可得到答案,需要熟知相邻原子间以共价键相结合而形成空间网状结构的晶体叫原子晶体.