��Ŀ����
����Ŀ��
��1���������й�������ȷ����( )
A������п�̵���У�MnO2�Ǵ���
B����пŦ�۵�ع���ʱ��Ag2O����ԭΪAg
C���ŵ�ʱ��Ǧ������������Ũ�Ȳ�������
D�����ʱ�����ƵĽ�����Ʒ���淢����ԭ��Ӧ
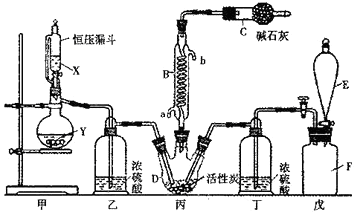
��2����п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�����Ҫ�ɷ�ΪZnS(��������FeS�������ɷ�)������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ��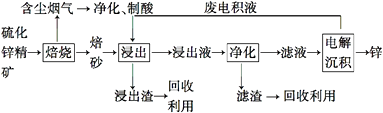
�ش��������⣺
��п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ��
��3�����չ����в����ĺ��������ɾ������ᣬ��������ں�����������
��4������Һ�������������м������Ҫ����Ϊ �� ����������
��5�������������е������������壬��������Pb-Ag�Ͻ���Ե缫�������ݳ���������
��6���Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʡ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ��
��7���ҹ��Ŵ������á�������ұ��п��������Ӧ�����ġ��칤������й��ڡ�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�������Ȼ�������ú̿����ʢ�������н�������Ѻ죬������������ٹ�ȡ��������������ǦҲ��������п���չ�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ��(ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п)
���𰸡�
��1��B��D
��2��ZnO
��3������
��4��п�ۣ��û���Fe��
��5��O2
��6��2ZnS+4H++O2=2Zn2++2S+2H2O
��7��ZnCO3+2C ![]() Zn+3CO����
Zn+3CO����
����������A������п�̵���У�MnO2��MnԪ�ػ��ϼ۽��ͣ�������ԭ��Ӧ������������A���������⣻
B����пŦ�۵�ع���ʱ��Ag2O������ԭ��Ӧ����Ag��B�������⣻
C��Ǧ�������ܵ�ط�ӦΪ��PbO2+2H2SO4+Pb ![]() 2PbSO4+2H2O����֪�ŵ�ʱǦ����������Ũ�Ȳ��ϼ�С��C���������⣻
2PbSO4+2H2O����֪�ŵ�ʱǦ����������Ũ�Ȳ��ϼ�С��C���������⣻
D�����ʱ���Ʋ��������ڶƼ��ŵ��γɶƲ㣬���ϼ۽��ͣ�������ԭ��Ӧ��D�������⣻
��2����п�����Ҫ�ɷ���ZnS�����������������������ԭ��Ӧ����ɰ����Ҫ�ɷ�ΪZnO��
��3���������ɵĺ����������ת��Ϊ���ᣬ���ں����Ľ���������
��4���ú�п���л�����FeS�����ʣ�����������ת��Ϊ�������ӣ��ɼ���п�۳�ȥ�������ӣ��Ӷ���ȥFe��
��5�������������У��ǵ��ZnSO4 �� ��������������Ӧ������ΪO2��
��6������ѹ�����������˼�壬��֪��Ӧ���к���H+��O2 �� ���Ի�÷ǽ�������S��д����ѧ����ʽΪ��2ZnS+4H++O2=2Zn2++2S��+2H2O��
��7��������Ŀ������֪��Ӧ��ΪZnCO3��C�����ﺬ��Zn����ѧ����ʽΪ��ZnCO3+2C ![]() Zn+3CO����
Zn+3CO����
�ʴ�Ϊ����1��BD����2��ZnO����3����������4��Zn�ۣ��û���Fe�ȣ���5��O2����6��2ZnS+4H++O2=2Zn2++2S��+2H2O����7��ZnCO3+2![]() Zn+3CO����1��A��п�̵���У�MnO2������ԭ��Ӧ��
Zn+3CO����1��A��п�̵���У�MnO2������ԭ��Ӧ��
B����пŦ�۵���У�������������ԭ��Ӧ�����������ʣ�
C��Ǧ���ط�Ӧ�����У��������
D����ƹ����У��Ʋ�����������ڶƼ��ϵõ��ӣ�
��.���չ����У�п���е�ZnS��FeS��������Ӧ������ZnO��Fe2O3����ϡ����������γ�����п����������Һ����ʱ�ټӹ���п�ۣ�����Һ�е����û��������ʣ��õ�����п��Һ�����е�⣬�Ӷ��õ�п���ʡ�

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д�