题目内容
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

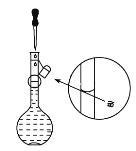
(一)某化学研究小组用如图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是_____(填铁、石墨),其电极反应式为_________。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为______(忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。
下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是_____(填序号,下同),加入_____调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是:_________。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是_______。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:________。
【答案】(1)石墨 2Cl--2e-==Cl2↑
(2)12 (3)b ;c
(4)将MgCl2·6H2O在干燥的HCl气流中加热
(5)富集溴元素 (6)Br2+SO2+2H2O=4H++SO42-+2Br-
【解析】
试题(1)在电解食盐水制氯气的装置中,Fe电极作阴极,石墨作阳极,则a电极为石墨;在阳极,溶液中的Cl-失电子生成氯气,电极反应为2Cl--2e-==Cl2↑。
(2)在电解食盐水制氯气的装置中,阴极H+得电子生成氢气,则阴极产生氢气的物质的量为0.0112L÷22.4L/mol=0.0005mol,根据化学反应2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,生成NaOH的物质的量为0.001mol,所以c(OH-)=0.001mol÷0.1L=0.01mol/L,pH=12。
2NaOH+H2↑+Cl2↑,生成NaOH的物质的量为0.001mol,所以c(OH-)=0.001mol÷0.1L=0.01mol/L,pH=12。
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是过氧化氢,化学反应为2H++2Fe2++H2O2=2Fe3++2H2O,氧化亚铁离子为铁离子且不会引入杂质离子,调节溶液PH除去Fe3+,加入的试剂不引入新的杂质应选择氧化镁,发生的反应为Fe3++3H2O![]() Fe(OH)3+3H+,MgO+2H+=Mg2++H2O;答案选b;c;
Fe(OH)3+3H+,MgO+2H+=Mg2++H2O;答案选b;c;
(4)如果直接在空气中加热MgCl26H2O,则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,则应将MgCl2·6H2O在干燥的HCl气流中加热;
(5)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素;
(6)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为Br2+SO2+2H2O=4H++SO42-+2Br-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】四种常见元素的性质或结构信息如F表所示,请问答下列问题。
元素 | A | B | R | D |
相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期IB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为________,已知有下列两种数据:
键能(kJ/mol) | 熔点(K) | 沸点(K)) | |
BO2 | B-O:452 | 1923 | 2503 |
DO2 | D=O:615,D-O:348 | 216 | 195 |
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
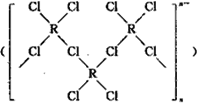
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。
(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。