题目内容
17.短周期元素Q、R、T、W在元素周期表中的位置如表所示,其中T所处的周期序数与族序数相等,请回答下列问题:| Q | R | ||
| T | W |
 .
.(2)元素的原子的得电子能力为:Q<W(填“>”或“<”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
分析 T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al;然后根据元素所在周期表中的位置可知Q为C、R为N、W为S元素,根据原子的结构特点结合元素周期律的递变规律以及对应单质、化合物的性质解答该题.
解答 解:T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al,再根据元素所在周期表中的位置可知Q为C、R为N、W为S元素,
(1)T为Al,为周期表13号元素,原子核外有3个电子层,最外层电子数为3,原子结构示意图为: ,
,
故答案为: ;
;
(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C,
故答案为:<;
(3)S与浓H2SO4发生反应,从元素守恒看,肯定有水生成,从化合价和性质分析,另外为一气体只能是SO2,则反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
点评 本题考查元位置、结构与性质的关系,题目难度中等,根据元素在周期表中相对位置推断出各元素为解答关键,注意掌握元素周期表结构、元素周期律内容.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
5.大气污染物NOx、SO2和可吸入颗粒物(PM2.5)等会危害人体健康,影响动植物生长因此应加强对其检测和治理.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
据此可判断试样中c(H+)=8×10-5mol/L.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
12.下列说法正确的是( )
| A. | 乙烯和苯都能发生加成反应 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖和蔗糖都可发生银镜反应 |
2.如图,表示正反应是吸热的是( )
| A. | 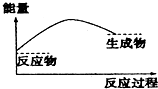 | B. | 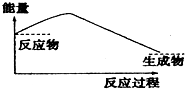 | ||
| C. | 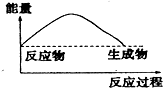 | D. |  |
7.核电荷数为16的元素和核电荷数为4的原子相比较,前者的下列数据是后者的4倍的是( )
| A. | 原子半径 | B. | 最外层电子数 | C. | 电子层数 | D. | 次外层电子数 |
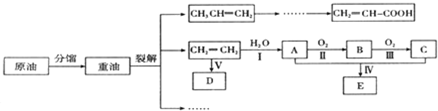
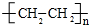 .
.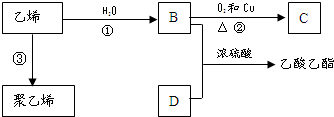 已知乙烯能发生如图转化
已知乙烯能发生如图转化 ,反应类型加聚反应.
,反应类型加聚反应.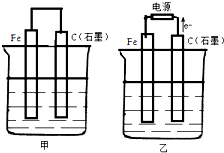 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.