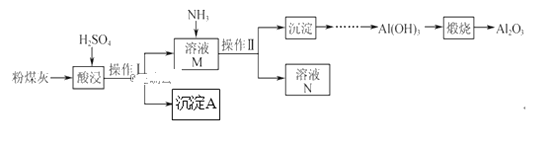
题目内容
【题目】(1)质量比为14 :15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为________
(2)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,下同)_________________;
(3)已知19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为______________________ ;
(4)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶1,则在含有2mol SO42-的混合物中,MgSO4的质量是________________克。
【答案】3:1 ②④③①⑤ 24 60
【解析】
(1)根据n=![]() 计算物质的量,根据N=n×NA计算分子数,进而计算原子数;(2)根据同温同压下,物质的量与体积呈正比判断体积关系;
计算物质的量,根据N=n×NA计算分子数,进而计算原子数;(2)根据同温同压下,物质的量与体积呈正比判断体积关系;
(3)先根据氯化物的分子式RCl2,由Cl-的物质的量求出氯化物的物质的量,再根据公式M=m÷n来确定分子的摩尔质量,摩尔质量在数值上和相对分子质量的大小相等,最后根据相对分子质量的大小确定金属元素的相对原子质量及RCl2的化学式;
(4)由电荷守恒可知溶液中存在2n(Mg2+)+3n(Al3+)=2n(SO42-),Al3+与Mg2+的物质的量之比为2:1,则在含有2mol SO42-的混合物中,
2n(Mg2+)+2×3n(Mg2+)=2n(SO42-),可知n(Mg2+)=0.5mol,以此解答.
(1)根据n=m÷M计算物质的量,混合气体中N2和NO的物质的量之比为14÷28:15÷30=1:1,
设混合气体都为1mol,则混合气体中氮原子的物质的量为3mol,氧原子的物质的量为1mol,根据N=n×NA,氮原子和氧原子的个数比为3:1,
故答案为:3:1;
(2)根据同温同压下,物质的量与体积呈正比,气体的物质的量越多,气体的体积就越大,同温同压下,五种气体的质量相同,根据n=m÷M计算物质的量,
由计算公式可以看出,质量相同时,物质的量与气体的摩尔质量呈反比,即摩尔质量越大,物质的量越小,
又知:①CO2 ②H2 ③O2 ④CH4 ⑤SO2的摩尔质量由大到小的顺序为:⑤SO2、①CO2、③O2、④CH4、②H2,
所以所占的体积由大到小的顺序是②④③①⑤,
故答案为:②④③①⑤;
(3)因氯化物RCl2中含有0.4molCl-可知,氯化物RCl2的物质的量为0.4mol÷2=0.2mol,则M(RCl2)=19g÷0.2mol==95g/mol,所以RCl2相对分子质量为95,R的相对原子量为95-71=24,
故答案为: 24;
(4)由电荷守恒可知溶液中存在2n(Mg2+)+3n(Al3+)=2n(SO42-),Al3+与Mg2+的物质的量之比为2:1,则在含有2mol SO42-的混合物中,
2n(Mg2+)+2×3n(Mg2+)=2n(SO42-),可知n(Mg2+)=0.5mol,则n(MgSO4)=0.5mol,
m(MgSO4)=0.5mol×120g/mol=60g,
故答案为:60。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图像序号与(1)—(4)对应的是
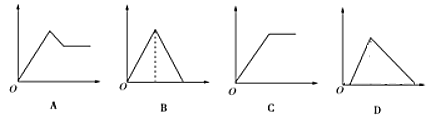
溶液 | 加入物质 | 对应的图像 |
(1)饱和石灰水 | 通过量CO2气体 | ____ |
(2)氯化铝溶液 | 加入过量氨水 | ____ |
(3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | ____ |
(4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | ____ |
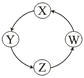
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④